��Ŀ����
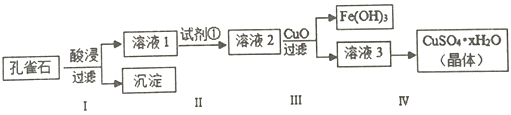
����Ŀ��һ���¶��£���1L�ܱ������м���1 mol HI(g)��������Ӧ2HI(g) ![]() H2(g)+I2(g)��H2���ʵ�����ʱ��ı仯��ͼ��ʾ��
H2(g)+I2(g)��H2���ʵ�����ʱ��ı仯��ͼ��ʾ��
��1��0~2 min�ڵ�ƽ����Ӧ����v(HI)=______________________�� ���¶��£�H2(g)+I2(g) ![]() 2HI(g)��ƽ�ⳣ��K=________��
2HI(g)��ƽ�ⳣ��K=________��
��2����ͬ�¶��£�����ʼ����HI(g)�����ʵ�����ԭ����2������_________ԭ����2����
a��ƽ�ⳣ�� b��HI��ƽ��Ũ��
c���ﵽƽ���ʱ�� d��ƽ��ʱH2���������
��3��ʵ������Zn��ϡ������ȡH2����Ӧʱ��Һ��ˮ�ĵ���ƽ��________�ƶ�������������ҡ������������������������Լ��е�_______������H2�����ʽ�����
a��NaNO3 b��CuSO4 c��Na2SO4 d��NaHSO3
��4��ij������ȼ�ϵ����CsHSO4����Ϊ����ʴ���H+��������ṹ��ͼ������ܷ�Ӧ�ɱ�ʾΪ2H2+O2===2H2O�������й�˵����ȷ����___________
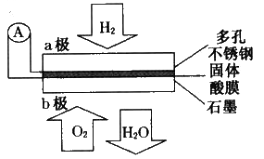
A������ͨ�����·��b������a��
B��b���ϵĵ缫��ӦʽΪ��O2+2H2O+4e��=4OH��
C��ÿת��0.1mol���ӣ�����1.12L��H2
D��H+��a��ͨ�����������ʴ��ݵ�b��
���𰸡�0.1 mol��L��1��min��1 64 b ���� b D
��������
2HI(g) ![]() H2(g)+I2(g)
H2(g)+I2(g)
��ʼ��mol��1 0 0
ת����mol��0.2 0.1 0.1
ƽ�⣨mol��0.8 0.1 0.1
0��2min�ڵ�ƽ����Ӧ����v(HI)=![]() =0.1 mol��L��1��min��1��
=0.1 mol��L��1��min��1��
ƽ�ⳣ��K/=![]() = 1/64��
= 1/64��
��ӦH2(g)+I2(g) ![]() 2HI(g)��ƽ�ⳣ��K=1/K/=64��
2HI(g)��ƽ�ⳣ��K=1/K/=64��
��ˣ�������ȷ���ǣ�64��
��2������ʼ����HI��g�������ʵ�����ԭ����2�����൱���Ƚ�HI���뵽2L���������ٽ����ѹ����1L����Ϊ�÷�ӦΪ�������Ӧ����ѹƽ�ⲻ�ƶ�������HI��Ũ��Ϊԭ����2����H2������������䣻�¶Ȳ��䣬ƽ�ⳣ�����䣻����HI�����ʵ�������Ӧ��Ũ������Ӧ���ʼӿ죬�ﵽƽ���ʱ�����̡���ѡb��
��ˣ�������ȷ���ǣ�b��
��3��ˮ�������������Ӻ����������ӣ�������������ˮ���룬п�����ᷴӦ��������п��������������Ũ����С��ˮ�ĵ���̶�����������ˮ�ĵ���ƽ�������ƶ���
a������Һ�м���NaNO3��������Һ�к������ᣬ�����п��Ӧ��������������a����
b��CuSO4��п�����û���Ӧ����ͭ��ͭ��п��ϡ���ṹ��ԭ��أ������ܼӿ췴Ӧ���ʣ���b��ȷ��
c��Na2SO4��Ӱ�췴Ӧ���ʣ���c����
d��NaHSO3�����ᷴӦ���ɶ�������������Ũ�ȼ�С�������������������ʼ�С����d����
��ˣ�������ȷ���ǣ����ң�b��
��4��A. ����ͨ�����·�Ӹ�����������������a������b������A����
B. ����ʴ���H+����b���ϵĵ缫��ӦʽΪO2+4e��+4H+=2H2O ����B����
C.ÿת��0.1mol����������0.05mol��H2����״���µ�H21.12L����״̬δ֪�����ܼ����������C������
D. ԭ����У��������������ƶ�������H+��a��ͨ�����������ʴ��ݵ�b��������Dѡ������ȷ����
��ˣ�������ȷ���ǣ�D��

����Ŀ����֪���ֶ�����Ԫ��a��g���й���Ϣ���±���ʾ��
Ԫ�ر�� | a | b | c | d | e | f | g |
ԭ�Ӱ뾶/nm | 0.037 | 0.074 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
����ϼۻ���ͻ��ϼ� | +1 | ��2 | +3 | ��2 | +3 | +1 | +1 |
�����ƶϲ���ȷ���ǣ�������
A. �⻯���ȶ��Ե�ǿ����b��dB. �����Ե�ǿ����f��g
C. Ԫ��e��������ֻ�����ᷴӦD. Ԫ��a��Ԫ��d�γɵĻ��������ڹ��ۻ�����