题目内容
已知某溶液中存OHˉ、H+、NH4+和C1ˉ四种离子,其浓度大小有如下关系:( )
①c(C1ˉ)>c(NH4+)>c(H+)>c(OH-)
②c(C1ˉ)>c(H+)>c(NH4+)>c(OH-)
③c(C1ˉ)=c(NH4+)且c(OHˉ)=c(H+)
④c(OHˉ)>c(H+)>c(C1ˉ)>c(NH4+)
⑤c(H+)>c(OH-)>c(C1-)>c(NH4+)
其中可能的是
| A.①④ | B.③⑤ | C.①②③ | D.④⑤ |
C
解析试题分析:①若是NH4Cl溶液或NH4Cl与少量的HCl混合溶液,则存在c(C1ˉ)>c(NH4+)>c(H+)>c(OH-),正确;②若是NH4Cl溶液与大量的HCl混合溶液,则存在c(C1ˉ)>c(H+)>c(NH4+)>c(OH-),正确;③若是NH4Cl溶液与少量的氨水混合溶液,则存在c(C1ˉ)=c(NH4+)且c(OHˉ)=c(H+),正确;④不符合电荷守恒,错误;⑤在任何盐溶液中,盐电离产生的离子浓度大于水电离产生的离子的浓度,错误。
考点:考查溶液中离子浓度的关系的知识。

(10分)某研究小组为了研究不同条件下金属铝粉在过量稀硫酸中的溶解性能,设计如下实验。已知:c(H2SO4)="4.5" mol·L-1,反应均需要搅拌60min。
| 编号 | 温度/℃ | 加入某盐 | H2SO4体积/mL | H2O体积/mL | 铝粉加入量/g | 铝粉溶解量 /g |
| ① | 20 | 不加 | 40 | 0 | 2.0050 | 0.0307 |
| ② | 80 | 不加 | 40 | 0 | 2.0050 | 0.1184 |
| ③ | t1 | 不加 | 20 | V1 | 2.0050 | ﹨ |
| ④ | t2 | 5 mL0.01 mol·L-1 CuSO4溶液 | 20 | V2 | 2.0050 | ﹨ |
为了获得铝粉溶解量,还需要测量的数据是 。
(2)实验①和③是为了研究硫酸的浓度对该反应的影响,则t1= ℃,V1= mL。
(3)实验③和④是为了研究加入CuSO4溶液对该反应的影响,则t2= ℃,V2= mL。
研究表明,在相同条件下加入少量CuSO4有利于Al的溶解。原因是 。
对常温下0.1 mol/L的醋酸溶液,以下说法正确的是
| A.由水电离出来的的c(H+)=1.0×10-13 mol/L |
| B.c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) |
| C.与同浓度的盐酸分别加水稀释10倍后:pH(醋酸)>pH(盐酸) |
| D.与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COO-)="0.1" mol/L |
某探究小组在某温度下测定溶液的pH时发现:0.01mol·L-1的NaOH溶液中,由水电离出的c(H+)·c(OH-)=10-22,则该小组在该温度下测得0.1mol·L-1NaOH溶液的pH应为
| A.13 | B.12 | C.11 | D.10 |
下列各离子浓度的大小比较,正确的是( )
| A.同浓度下列溶液中:① (NH4)2SO4 ② NH4HCO3 ③ NH4Cl④ NH3·H2O, c(NH4+)由大到小的顺序是:① > ③ > ② > ④ |
| B.常温时,将等体积的盐酸和氨水混合后,pH = 7,则c (NH4+) > c (Cl-) |
| C.0.2 mol·L-1 Na2CO3溶液中:c (OH-) =" c" (HCO3-) + c (H+) + c (H2CO3) |
| D.0.01 mol·L-1 的NH4Cl溶液与0.05mol·L-1 的NaOH溶液等体积混合: c (Cl-)> c (NH4+)> c (Na+)>c (OH-)>c (H+) |
已知,25℃时有关弱酸的电离平衡常数如下: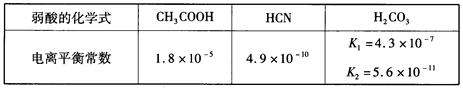
则下列有关说法正确的是( )
| A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
| B.a mol·L-1 HCN溶液与b mol·L-1NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则b一定大于a |
| C.向冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小 |
| D.等物质的量NaHCO3和Na2CO3的混合溶液中,一定存在: c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
若醋酸用HAc表示,则在0.1mol·L-1 NaAc溶液中,下列离子浓度关系正确的是
| A.c(Na+)= c(Ac—)+c(HAc) |
| B.c(Na+)+c(OH—)= c(Ac—)+c(H+) |
| C.c(Na+)>c(OH—) > c(Ac—) > c(H+) |
| D.c(Na+)> c(Ac—)> c(H+)> c(OH—) |
现有体积相同、pH均为2的盐酸和醋酸,下列叙述错误的是
| A.盐酸溶液中的c(Cl-)与醋酸溶液中的c(CH3COO-)相等 |
| B.它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多 |
| C.分别用水稀释相同倍数时,n(Cl-)<n(CH3COO-) |
| D.它们分别与足量CaCO3反应时,放出的CO2一样多 |
