题目内容
【题目】新技术的开发应用,不仅有利于改善环境质量,而且能充分开发“废物”的潜在价值。回答下列问题:
(1)用烟道气与氢气来合成甲醇涉及到如下几个反应:
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]() _____________
_____________![]() 。
。
(2)在容积均为![]() 的两个恒容密闭容器中发生反应
的两个恒容密闭容器中发生反应![]() ,有关数据如下:
,有关数据如下:
容器 | 温度 | 起始量 | 达到平衡 | |||
|
|
| CO转化率 | 所需时间 | ||
1 | 800 | 2 | 1 |
| 3 | |
2 | 800 | 1 | 2 | n | x | |
①![]() 时该反应的平衡常数
时该反应的平衡常数![]() ___________。
___________。
②容器2中,![]() ___________,
___________,![]() ___________。
___________。
③若![]() 起始时,在
起始时,在![]() 恒容密闭容器中加入CO、
恒容密闭容器中加入CO、![]() 、
、![]() 、
、![]() 各
各![]() ,则此时
,则此时![]() ___________
___________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
(3)反应![]()
![]() 可用于捕捉空气中的
可用于捕捉空气中的![]() ,为研究温度对
,为研究温度对![]() 捕获
捕获![]() 效率的影响,在某温度
效率的影响,在某温度![]() 下,将一定量的
下,将一定量的![]() 溶液置于密闭容器中,并充入一定量的
溶液置于密闭容器中,并充入一定量的![]() 气体,在t时刻,测得容器中
气体,在t时刻,测得容器中![]() 气体的浓度。然后分别在温度为
气体的浓度。然后分别在温度为![]() 、
、![]() 、
、![]() 、
、![]() 下,保持其他初始实验条件不变,重复上述实验,经过相同时间测定
下,保持其他初始实验条件不变,重复上述实验,经过相同时间测定![]() 气体的浓度,得到的曲线图如下:
气体的浓度,得到的曲线图如下:
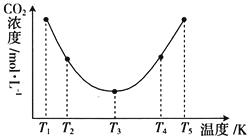
①![]() ____________
____________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。![]() 区间,
区间,![]() 变化的原因是_____________。
变化的原因是_____________。
②已知常温下![]() 的电离常数
的电离常数![]() ,碳酸的电离常数
,碳酸的电离常数![]() 、
、![]() ,则恰好完全反应时所得的
,则恰好完全反应时所得的![]() 溶液中
溶液中![]() __________
__________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
③在图中所示五种温度下,该反应的平衡常数最大的温度是____________。
【答案】![]()
![]()
![]() 或
或![]()
![]()
![]()
![]()
![]() 区间,化学反应未达到平衡,且温度越高,反应速率越快,相同时间内
区间,化学反应未达到平衡,且温度越高,反应速率越快,相同时间内![]() 溶液捕获的
溶液捕获的![]() 就越多,则剩余的
就越多,则剩余的![]() 气体浓度就越小
气体浓度就越小 ![]()
![]()
【解析】
(1)①CO(g)+2H2(g)=CH3OH(g) ΔH=-91 kJ·mol-1
②2CO2(g)=2CO(g)+O2(g) ΔH=+566 kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1
根据盖斯定律④CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=①+![]() +
+![]() =-91 kJ·mol-1+
=-91 kJ·mol-1+![]() 566 kJ·mol-1+
566 kJ·mol-1+![]() (-483.6 kJ·mol-1)=-49.8kJ·mol-1;
(-483.6 kJ·mol-1)=-49.8kJ·mol-1;
(2)由容器 1数据可知
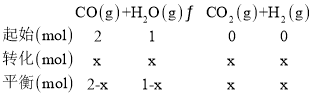
![]() ,x=
,x=![]() ,
,
①800℃时该反应的平衡常数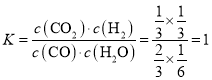 ;
;
②因为温度不变,则 K不变,
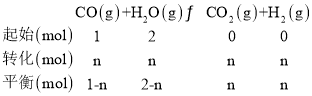
K=1= ,解得n=
,解得n=![]() ,x=
,x=![]() (或66.7%);
(或66.7%);
③若800℃起始时,在2 L恒容密闭容器中加入CO、H2O、CO2、H2各1 mol,根据Qc=1=K,则此时v正=v逆;
(3)在图中CO2的浓度存在一最低点,则在T1~T2区间,反应未达到化学平衡,温度升高,反应速率加快,CO2被捕捉的量增加,剩余CO2的浓度减小;T4~T5区间,反应已达到化学平衡,升高温度剩余CO2的浓度增大,即升高温度,平衡向左移动,因此正反应为放热反应,即ΔH<0;T1~T2区间,c(CO2)变化的原因是化学反应未达到平衡,且温度越高,反应速率越快,相同时间内(NH4)2CO3溶液捕获的CO2就越多,则剩余的CO2气体浓度就越小;
②由电离常数可知,![]() 的水解能力弱于
的水解能力弱于![]() 的水解能力,而
的水解能力,而![]() 的水解能力强于其电离能力,故溶液呈碱性即c(H+)<c(OH-);
的水解能力强于其电离能力,故溶液呈碱性即c(H+)<c(OH-);
③根据①可知该反应是放热反应,温度越高平衡常数越小,则在图中所示五种温度下,该反应的平衡常数最大的温度是T1。