题目内容
0.05molCmHnCOOH与Br2完全加成时需Br28g,0.1mol该有机物完全燃烧时产生CO2和H2O的物质的量之和为3.5mol,试通过计算确定该有机酸的分子式.
0.05molCmHnCOOH加成时需8g溴,即n(Br2)=
=0.05mol,说明分子中含有1个C=C键,符合通式CxH2x-2O2,所以n+1=2(m+1)-2,即n=2m-1,碳原子数至少是3个,0.1mol该有机物CmHnCOOH完全燃烧时,生成二氧化碳是0.1(m+1)mol,生成水是0.05(n+1)mol,产生CO2和H2O的物质的量之和为3.5mol,则0.05(n+1)mol+0.1(m+1)mol=3.5mol,即0.5n+m=33.5,联立n=2m-1,可得m=17,n=33,该有机酸的分子式为C18H34O2,
答:该有机酸的分子式为C18H34O2.
| 8g |
| 160g/mol |
答:该有机酸的分子式为C18H34O2.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案
相关题目
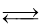
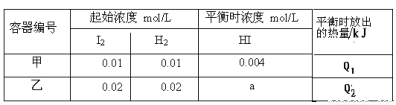


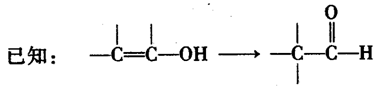
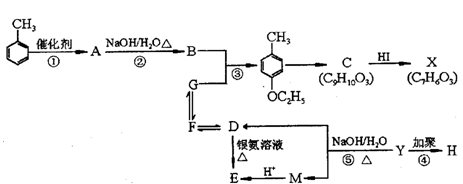
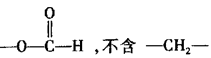 的
的