题目内容
【题目】(本题满分18分)二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
编号 | 热化学方程式 | 化学平衡常数 |
① | CO(g)+2H2(g) | K1 |
② | 2CH3OH(g) | K2 |
③ | CO(g)+H2O(g) | K3 |
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H﹣H | C﹣O | C=O | H﹣O | C﹣H |
E/(kJ.mol﹣1) | 436 | 343 | 1076 | 45 | 413 |
由上述数据计算△H1= ;
(2)该工艺的总反应为3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g)△H,该反应△H= ,化学平衡常数K= (用含K1、K2、K3的代数式表示);
CH3OCH3(g)+CO2(g)△H,该反应△H= ,化学平衡常数K= (用含K1、K2、K3的代数式表示);
(3)下列措施中,能提高CH3OCH3产率的有 ;
A.分离出二甲醚 B.升高温度
C.改用高效催化剂 D.增大压强
(4)工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.该工艺中反应③的发生提高了CH3OCH3的产率,原因是 ;
(5)以n(H2)/n(CO)=2 通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是 ;
CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是 ;
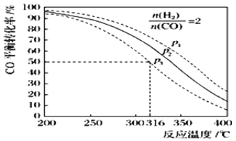
A.该反应的△H>0
B.若在p2和316℃时反应达到平衡,则CO的转化率小于50%
C.若在p3和316℃时反应达到平衡,H2的转化率等于50%
D.若在p3和316℃时,起始时n(H2)/n(CO)=3,则达平衡时CO的转化率大于50%
E.若在p1和200℃时,反应达平衡后保持温度和压强不变,再充入2mol H2和1mol CO,则平衡时二甲醚的体积分数增大
(6)某温度下,将8.0mol H2和4.0mol CO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g)CH3OCH3(g)+H2O(g),反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数K= .
【答案】(1)﹣99 kJmol﹣1 (2)﹣263 kJmol﹣1;K=K12K2K3 (3)AD;
(4)反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率; (5)CD (6)2.25
【解析】
试题分析:(1)由△H等于反应物的键能减去生成物的键能,可求得反应①的△H1=1076+2×436-343-465-3×413=-99 kJmol-1;
(2)由盖斯定律可得,总反应3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g)为方程式①×2+②+③相加所得,故△H=2△H1+△H2+△H3=2×(-99)-24-41=-263 kJmol-1;总反应的平衡常数等于分反应的平衡常数之积,则K=K12K2K3;
CH3OCH3(g)+CO2(g)为方程式①×2+②+③相加所得,故△H=2△H1+△H2+△H3=2×(-99)-24-41=-263 kJmol-1;总反应的平衡常数等于分反应的平衡常数之积,则K=K12K2K3;
(3)由勒夏特列原理,对于3CO(g)+3H2(g) ![]() CH3OCH3(g)+CO2(g)为了提高CH3OCH3产率,反应需要向正反应方向移动,因此通过减小气体体积、降温、减少产物的量可以实现,而催化剂对化学平衡的移动没有影响,由此可知A、D正确;
CH3OCH3(g)+CO2(g)为了提高CH3OCH3产率,反应需要向正反应方向移动,因此通过减小气体体积、降温、减少产物的量可以实现,而催化剂对化学平衡的移动没有影响,由此可知A、D正确;
(4)反应②2CH3OH(g)CH3OCH3(g)+H2O(g),反应③CO(g)+H2O(g)CO2(g)+H2(g),由此可知,反应③消耗反应②中的水,根据勒夏特列原理可知,可提高CH3OCH3的产率;
(5)由图象可知,反应温度升高,CO的转化率降低,说明该正反应方向为放热反应,△H<0,A错误;找出p2,316℃坐标点,可知CO的转化率大于50%,B错误;由图可知,p3,316℃时,CO的转化率为50%,而此时H2和CO的物质的量之比等于系数比,即两者的转化率相等,所以H2的转化率也为50%,C正确;若增大H2和CO的物质的量之比,则平衡正向移动,CO的转化率也同时升高,D正确;根据等效平衡的原理,保持温度和压强不变,充入与起始时等比值的氢气和CO,两种平衡等效,二甲醚的体积分数不变,E错误;故答案为CD;
(6)设平衡时CH3OCH3的物质的量为xmol,由4H2(g)+2CO(g)CH3OCH3(g)+H2O(g),平衡时各物质的浓度分别为:[H2]=4-2x,[CO]=2-x,[CH3OCH3]=x/2,[H2O]=x/2;二甲醚的体积分数为25%,也即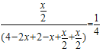 ,解得x=3/2;所以平衡时各物质的浓度分别为:[H2]=1,[CO]=0.5,[CH3OCH3]=0.75,[H2O]=0.75,所以平衡常数K=
,解得x=3/2;所以平衡时各物质的浓度分别为:[H2]=1,[CO]=0.5,[CH3OCH3]=0.75,[H2O]=0.75,所以平衡常数K=![]() =2.25。
=2.25。

 金博士一点全通系列答案
金博士一点全通系列答案【题目】“一器多用”可实现多方面的化学实验探究,某课外活动小组学生利用图15所示的仪器组合(省略夹持和净化装置)来完成下列实验,回答下列问题:
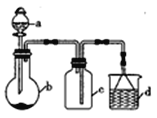
(1)仪器a的名称为______________,仪器a在使用前要________________。
(2)该装置可用于某些气体的制取、收集及尾气处理裝置,下表中3个实验的设计方案合理的是_________________(填序号)
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 稀硝酸 | Cu | NO | H2O |
B | 稀H2SO4 | CaCO3 | CO2 | NaOH溶液 |
C | 浓氨水 | NaOH固体 | NH3 | H2O |
(3)氨气和氯气接触时会产生白烟,请写出相应的化学方程式:_______________________。
(4)上述装置若a中的物质为浓硫酸,b中的物质为Cu片,在加热条件下也可制取SO2。
①下列装置可用于SO2尾气处理的是(夹持仪器已略去)_____________(填序号)。
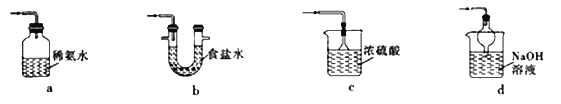
用Fe2(SO4)3溶液也可吸收多余的SO2气体.写出SO2与Fe2(SO4)3溶液反应的离子方程式:_______________________。
②某小组用反应产生的CuSO4溶液来制取胆矾,测定所得胆矾(CuSO4·xH2O)中结晶水x的值,各次 称量的数据如下表:
称量 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
质量(g) | m1=5.4 | m2=8.2 | m3=7.4 | m4=7.2 | m5=7.2 |
则胆矾应放在____________(填仪器名称)中加热;必须要进行恒重操作的原因是__________________;CuSO4·xH2O中的x=___________(保留1位小数);若测定结果x偏大,可能的原因是____________(填序号)。
a.加热温度过高 b.胆矾晶体的颗粒较大 c.加热后放在空气中冷却