题目内容
【题目】“一器多用”可实现多方面的化学实验探究,某课外活动小组学生利用图15所示的仪器组合(省略夹持和净化装置)来完成下列实验,回答下列问题:

(1)仪器a的名称为______________,仪器a在使用前要________________。
(2)该装置可用于某些气体的制取、收集及尾气处理裝置,下表中3个实验的设计方案合理的是_________________(填序号)
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 稀硝酸 | Cu | NO | H2O |
B | 稀H2SO4 | CaCO3 | CO2 | NaOH溶液 |
C | 浓氨水 | NaOH固体 | NH3 | H2O |
(3)氨气和氯气接触时会产生白烟,请写出相应的化学方程式:_______________________。
(4)上述装置若a中的物质为浓硫酸,b中的物质为Cu片,在加热条件下也可制取SO2。
①下列装置可用于SO2尾气处理的是(夹持仪器已略去)_____________(填序号)。

用Fe2(SO4)3溶液也可吸收多余的SO2气体.写出SO2与Fe2(SO4)3溶液反应的离子方程式:_______________________。
②某小组用反应产生的CuSO4溶液来制取胆矾,测定所得胆矾(CuSO4·xH2O)中结晶水x的值,各次 称量的数据如下表:
称量 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
质量(g) | m1=5.4 | m2=8.2 | m3=7.4 | m4=7.2 | m5=7.2 |
则胆矾应放在____________(填仪器名称)中加热;必须要进行恒重操作的原因是__________________;CuSO4·xH2O中的x=___________(保留1位小数);若测定结果x偏大,可能的原因是____________(填序号)。
a.加热温度过高 b.胆矾晶体的颗粒较大 c.加热后放在空气中冷却
【答案】(1)分液漏斗;查漏
(2)C
(3)8NH3+3Cl2=6NH4Cl+N2
(4)①d;2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
②坩埚;确保硫酸铜晶体完全失去结晶水;4.9;a
【解析】
试题分析:(1)依据仪器的结构特点可知仪器a的名称为分液漏斗;使用分液漏斗前一定要检查是否漏液。
(2)A.由于NO极易被空气中氧气氧化,该装置不能收集到纯净的NO气体,故A错误;B.的密度比空气大,应选择向上排空气法,故B错误;C.该装置可以完成氨气的制取、收集和尾气处理,故C正确。
(3)氨气和氯气接触时会发生氧化还原反应生成氯化铵固体和氮气,看到白烟产生,该反应的化学方程式为:8NH3+3Cl2=6NH4Cl+N2。
(4)上述装置若a中的物质为浓硫酸,b中的物质为Cu片,在加热条件下也可制取。
①a.广口瓶密闭,且导管没有将SO2通入页面下,故a错误;b.食盐水不能与二氧化硫反应,且导管没有将SO2通入页面下,故b错误;c.浓硫酸不能用来吸收SO2气体,故c错误;d.二氧化硫能与氢氧化钠反应生成亚硫酸钠,所以该装置可用于SO2尾气处理,故d正确。用Fe2(SO4)3溶液也可吸收多余的SO2气体,SO2与Fe2(SO4)3溶液反应的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+。
②某小组用反应产生的CuSO4溶液来制取胆矾,测定所得胆矾(CuSO4·xH2O)中结晶水x的值。依据表中数据可知开始称取坩埚质量为5.4g,则CuSO4·xH2O的质量为8.2g-5.4g=2.8g,充分加热至恒重以确保硫酸铜晶体完全失去结晶水,得无水CuSO4的质量为7.2g-5.4g=1.8g;晶体中含有结晶水是质量为8.2g-7.2g=1.0g。
依据关系式:CuSO4xH2O→CuSO4→xH2O,
160g 18xg
1.8g 1.0g
解得x=4.9;
a.热温度过高会造成部分分解CuSO4,测定结果x偏大,故a正确;b.胆矾晶体的颗粒较大可能会造成结晶水不能完全失去,测定结果偏低,故b错误;c.加热后放在空气中冷却,会吸收空气中的水分会造成测定结果偏低,故c错误。

 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】(本题满分18分)二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
编号 | 热化学方程式 | 化学平衡常数 |
① | CO(g)+2H2(g) | K1 |
② | 2CH3OH(g) | K2 |
③ | CO(g)+H2O(g) | K3 |
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H﹣H | C﹣O | C=O | H﹣O | C﹣H |
E/(kJ.mol﹣1) | 436 | 343 | 1076 | 45 | 413 |
由上述数据计算△H1= ;
(2)该工艺的总反应为3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g)△H,该反应△H= ,化学平衡常数K= (用含K1、K2、K3的代数式表示);
CH3OCH3(g)+CO2(g)△H,该反应△H= ,化学平衡常数K= (用含K1、K2、K3的代数式表示);
(3)下列措施中,能提高CH3OCH3产率的有 ;
A.分离出二甲醚 B.升高温度
C.改用高效催化剂 D.增大压强
(4)工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.该工艺中反应③的发生提高了CH3OCH3的产率,原因是 ;
(5)以n(H2)/n(CO)=2 通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是 ;
CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是 ;
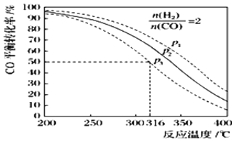
A.该反应的△H>0
B.若在p2和316℃时反应达到平衡,则CO的转化率小于50%
C.若在p3和316℃时反应达到平衡,H2的转化率等于50%
D.若在p3和316℃时,起始时n(H2)/n(CO)=3,则达平衡时CO的转化率大于50%
E.若在p1和200℃时,反应达平衡后保持温度和压强不变,再充入2mol H2和1mol CO,则平衡时二甲醚的体积分数增大
(6)某温度下,将8.0mol H2和4.0mol CO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g)CH3OCH3(g)+H2O(g),反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数K= .