题目内容
短周期元素中:A是地壳中含量最高的元素;B比Ne的质子数多1个;C最外层电子数与其电子层数相等;D单质是半导体材料;E非金属性在同周期元素中最强。下列说法中正确的是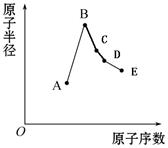
A.B离子的半径比C离子的半径小
B.A、B两单质反应可得到两种不同的离子化合物
C.C单质与A或E单质形成的化合物均为离子化合
D.B最高价氧化物对应的水合物与D单质发生反应能产生气体
BD
解析试题分析:地壳中含量最高的是氧,则A是氧;氖原子的质子数为10,10+1=11,则B是钠;B、C的周期序数都是3,C最外层电子数与其电子层数相等,即其原子具有283的电子层结构,则C是铝;第三周期硅元素的单质是半导体,则D是硅;第三周期非金属性最强的是氯,则E是氯。B、C是钠、铝,钠离子和铝离子都具有28电子层结构,电子层数相同,但钠离子的核电荷数小于铝离子,所以钠离子半径大于铝离子半径,故A错;A、B是氧、钠,分别是活泼非金属、活泼金属,则氧气与金属钠在常温和加热时反应,分别得到氧化钠、过氧化钠,它们都是离子化合物,故B正确;C、A、E分别是铝、氧、氯,工业上电解熔融氧化铝制备铝,说明氧化铝是离子化合物,而氯化铝是共价化合物,因为铝位于金属与非金属交界处,铝是具有非金属性的金属,与非金属氯结合生成共价化合物,故C错;B、D分别是钠、硅,钠的最高价氧化物对应水化物为氢氧化钠,氢氧化钠是强碱,单质硅是非金属单质,因此前者可以溶解后者,即Si+2NaOH+H2O=Na2SiO3+2H2↑,故D正确。
考点:考查物质结构和元素周期律,涉及元素在周期表的位置、物质结构、元素及其化合物的主要性质之间的综合推断等。

 53随堂测系列答案
53随堂测系列答案几种短周期元素的原子半径及主要化合价如下表 ( )
| 元素代号 | X | Y | Z | M | N | P |
| 原子半径/nm | 0.186 | 0.143 | 0.075 | 0.074 | 0.152 | 0.099 |
| 元素的主要化合价 | +1 | +3 | +5、-3 | -2 | +1 | +7、-1 |
下列叙述错误的是(其中NA表示阿伏加德罗常数的值)
A.X、N元素的金属性:X>N
B.Y、M元素形成的离子化合物是工业冶炼Y的原料
C.X单质在M单质中燃烧生成的化合物39g中共含有0.5NA个阴离子
D.标准状况下1L 1mol·L-1的YP3溶液中含有NA个Y3+离子
下图为元素周期表中短周期的一部分,下列说法正确的是
| ① | ② | ③ |
| ④ | ⑤ | ⑥ |
A.①~⑥可能全部是非金属元素
B.对应单质的活泼性:②>③
C.④的最高价氧化物对应的水化物可能为两性物质
D.②、⑤的最高价氧化物对应的水化物可能均为强酸
X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如下图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的
| | | X | Y |
| Z | W | | |
A.Y元素最高价氧化物对应的水化物化学式为H3YO4
B.原子半径由小到大的顺序为:X<Z<Y<W
C.与同浓度的盐酸反应,Z比W更剧烈
D.X的氧化物不能与Z单质反应
短周期元素M、W、X、Y、Z的原子序数依次增大,M元素的一种核素没有中子,且M、W、X、Y+、Z的最外层电子数与其电子层数的比值依次为1、2、3、4、2(不考虑零族元素)。下列关于这些元素的叙述正确的是
| A.X分别和其它四种元素均可形成至少2种化合物 |
| B.M分别和W、X、Y、Z形成化合物,均显相同化合价 |
| C.M、X、Z三种元素组成的化合物含有离子键 |
| D.M、X、Y组成化合物和Y、Z组成化合物,其水溶液均呈碱性 |
关于原子结构、元素性质的说法正确的是
| A.随原予序数的递增,元素原子的核外电子数增多,原子半径逐渐减小 |
| B.若两种不同的核素具有相同的中子数,则二者一定不属于同种元素 |
| C.若两种元素原子的最外层电子数相同,则元素最高正价一定相同 |
| D.电子层结构相同的微粒,其化学性质一定相似 |
如图所示是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
| A.R的单质能与W的氢化物反应,可证明非金属性:R>W |
| B.最高正价氧化物对应的水化物的酸性:R<W |
| C.X与Z组成的化合物是共价化合物,且又具有两性 |
| D.离子半径:Z>Y>X |
下列不能说明氯的非金属性比硫强的事实是 ( )
①HCl比H2S稳定 ②HCl和H2S的水溶液前者的的酸性强
③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S
⑤Cl原子能得1个电子变成稳定离子而S原子能得两个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
| A.①②④ | B.① ②⑥ | C.②⑤ | D.①③⑤ |
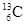 -NMR(核磁共振)可以用于含碳化合物的结构分析。
-NMR(核磁共振)可以用于含碳化合物的结构分析。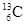 表示的碳原子
表示的碳原子
| A.核外有13个电子,其中4个能参与成键 |
| B.核内有6个质子,核外有7个电子 |
| C.质量数为13,原子序数为6,核内有7个质子 |
| D.质量数为13,原子序数为6,核内有7个中子 |