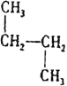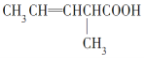题目内容
【题目】易混易错题组:按题目要求填写下列空白。
(1) 用价层电子对互斥模型预测下列微粒的立体结构,并指出后两种物质中中心原子的杂化方式。
H2Se______________ CF4_______________SO2______________ 、______SO42-______________、_______
(学法题)简述价层电子对互斥模型与分子的立体结构之间的关系_________________________
(2)写出下列物质的系统命名:
①(CH3)3COH________________②CH3CHClCOOH ___________________
③![]() ________________ ④
________________ ④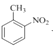 ________________
________________
(3)下列原子核外电子排布中,违背“泡利不相容原理”的是_________;违背“洪特规则”的是_______;违背“洪特 规则特例”的是___________。违背“能量最低原理”的是________;(填编号)
① 6 C轨道表示为![]()
②7N轨道表示为:![]()
③29 Cu电子排布式为:1s 2 2s 2 2p 6 3s 2 3p 6 3d 9 4s 2
④20 Ca电子排布式为:1s 2 2s 2 2p 6 3s 2 3p 6 3d 2
⑤O: ![]()
(学法题)在解答此题时必须明确概念,简述泡利原理,洪特规则的概念:___________________________
(4)按要求书写化学方程式
①CH3CH(OH)CH3的催化氧化:__________________________________________
②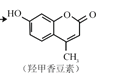 和氢氧化钠溶液反应____________________________________________
和氢氧化钠溶液反应____________________________________________
③过量乙酸与甘油的酯化反应_________________________________________________
【答案】四面体 正四体 平面三角形 sp2 正四面体 sp3 VSEPR模型可用来预测分子的立体构型,注意实际空间构型要去掉孤电子对 2-甲基-2-丙醇 2-氯丙酸 3-乙基戊烷 2-硝基甲苯 ⑤ ② ③ ④ 泡利原理为每个原子轨道上最多只能容纳2个自旋状态相反的电子;洪特规则为洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同; 2 CH3CH(OH)CH3+O2![]() 2 CH3COCH3+ 2H2O
2 CH3COCH3+ 2H2O 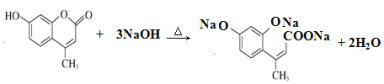

【解析】
(1) H2Se中心原子Se原子成2个σ键、含有2对孤对电子,故杂化轨道数为4,采取sp3杂化,故空间结构为四面体;CF4中心原子C原子形成4个σ键、含有2对孤对电子,故杂化轨道数为4,采取sp3杂化,故空间结构为正四体形;SO2中心原子上的孤对电子数为![]() =1,价层电子对个数为2,杂化轨道数为3,采取,故采取sp2杂化,空间结构为平面三角形;SO42-中含孤电子对为
=1,价层电子对个数为2,杂化轨道数为3,采取,故采取sp2杂化,空间结构为平面三角形;SO42-中含孤电子对为![]() =0,价层电子对个数都是4,故采取sp3杂化,所以空间构型都是正四面体结构;根据价层电子对互斥模型用来预测分子的立体构型,注意实际空间构型要去掉孤电子对;
=0,价层电子对个数都是4,故采取sp3杂化,所以空间构型都是正四面体结构;根据价层电子对互斥模型用来预测分子的立体构型,注意实际空间构型要去掉孤电子对;
(2)①根据系统命名法,有机物(CH3)3COH的名称为2-甲基-2-丙醇;②CH3CHClCOOH 的名称为2-氯丙酸;③![]() 的名称为3-乙基戊烷;④
的名称为3-乙基戊烷;④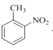 的名称为2-硝基甲苯;
的名称为2-硝基甲苯;
(3)①洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同,则6 C轨道表达式为![]() ;②洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同,则7N轨道表示为
;②洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同,则7N轨道表示为![]() 时违背洪特规则;③当电子排布为全充满、半充满或全空时相对稳定,则29 Cu电子排布式为1s 2 2s 2 2p 6 3s 2 3p 6 3d 9 4s 2时违背了洪特规则特例;④能量最低原理是原子核外电子先占有能量低的轨道,然后依次进入能量高的轨道,则20 Ca电子排布式为:1s22s 22p63s23p 63d2违背了能量最低原理,其正确的电子排布式为1s22s 22p63s23p 64s2;⑤泡利不相容原理是指每个原子轨道上最多只能容纳2个自旋状态相反的电子,则O:
时违背洪特规则;③当电子排布为全充满、半充满或全空时相对稳定,则29 Cu电子排布式为1s 2 2s 2 2p 6 3s 2 3p 6 3d 9 4s 2时违背了洪特规则特例;④能量最低原理是原子核外电子先占有能量低的轨道,然后依次进入能量高的轨道,则20 Ca电子排布式为:1s22s 22p63s23p 63d2违背了能量最低原理,其正确的电子排布式为1s22s 22p63s23p 64s2;⑤泡利不相容原理是指每个原子轨道上最多只能容纳2个自旋状态相反的电子,则O: ![]() 违背泡利不相容原理;
违背泡利不相容原理;
故违背“泡利不相容原理”的是⑤;违背“洪特规则”的是②;违背“洪特规则特例”的是③;违背“能量最低原理”的是④;
在解答此题时必须明确概念,其中泡利原理为每个原子轨道上最多只能容纳2个自旋状态相反的电子;洪特规则为洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同;
(4)①CH3CH(OH)CH3在Cu作催化剂的条件下加热催化氧化生成丙酮,发生反应的化学方程式为2 CH3CH(OH)CH3+O2![]() 2 CH3COCH3+ 2H2O;
2 CH3COCH3+ 2H2O;
②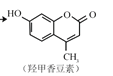 和氢氧化钠溶液反应时发生反应的化学方程式为
和氢氧化钠溶液反应时发生反应的化学方程式为 ;
;
③过量乙酸与甘油的酯化反应的化学方程式为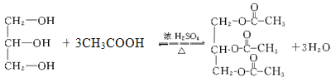 。
。