题目内容
【题目】铬铁矿的主要成分可表示为FeOCr2O3 , 还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图: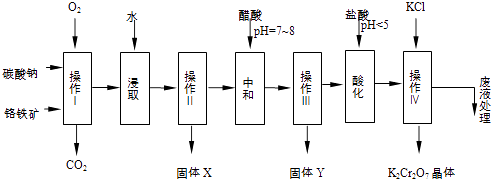
已知:
①4FeOCr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3 ![]() 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
根据题意回答下列问题:
(1)操作I在常温下该反应速度极慢,下列措施中能使反应速率增大的是 .
A.升高温度
B.通入过量的空气
C.将原料粉碎
D.增加纯碱的用量
(2)固体X中主要含有(填写化学式);
(3)酸化步骤用盐酸调节溶液pH<5,并煮沸其目的是 . (离子方程式表示)
(4)操作 iv有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、、、洗涤、干燥.
(5)表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.该反应在溶液中能发生的理由是 . (文字说明)
物质 | 溶解度/(g/100g水) | ||
0°C | 40°C | 80°C | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
(6)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量(填写试剂)、溶解、过滤、再(填写试剂)、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为(用含m、n的代数式表示).
【答案】
(1)ABC
(2)Fe2O3、MgO
(3)Cr2O72﹣+H2O═2CrO42﹣+2H+
(4)冷却结晶;过滤
(5)K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小)
(6)NaOH溶液;通入过量二氧化碳;![]()
【解析】解:(1)A.升高温度,可以加快反应速率,故A正确; B.通入过量的空气,增大了氧气的量,可以加快反应速率,故B正确; C.将原料粉碎,增大了接触面积,可以加快反应速率,故C正确;D.纯碱是固体,不涉及浓度问题,所以改变纯碱的量,不能改变反应速率,故D错误;所以答案是:ABC;(2)铬铁矿的主要成分可表示为FeOCr2O3 , 还含有MgO、Al2O3、Fe2O3等杂质,加入氧气和碳酸钠,发生反应为:4FeOCr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2↑;Na2CO3+Al2O3
8Na2CrO4+2Fe2O3+8CO2↑;Na2CO3+Al2O3 ![]() 2NaAlO2+CO2↑;Cr2O72﹣+H2O2CrO42﹣+2H+ , 操作Ⅰ是过滤得到固体X为Fe2O3、MgO,所以答案是:Fe2O3、MgO;(3)酸化步骤用醋酸调节溶液pH<5,依据流程图中物质的转化和制备目的可知,结合反应平衡Cr2O72﹣+H2O2CrO42﹣+2H+ , 加入酸,氢离子浓度增大,平衡左移,作用是使CrO42﹣转化为Cr2O72﹣ , 所以答案是:Cr2O72﹣+H2O═2CrO42﹣+2H+;(4)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩,冷却结晶、过滤、洗涤、干燥得到晶体,
2NaAlO2+CO2↑;Cr2O72﹣+H2O2CrO42﹣+2H+ , 操作Ⅰ是过滤得到固体X为Fe2O3、MgO,所以答案是:Fe2O3、MgO;(3)酸化步骤用醋酸调节溶液pH<5,依据流程图中物质的转化和制备目的可知,结合反应平衡Cr2O72﹣+H2O2CrO42﹣+2H+ , 加入酸,氢离子浓度增大,平衡左移,作用是使CrO42﹣转化为Cr2O72﹣ , 所以答案是:Cr2O72﹣+H2O═2CrO42﹣+2H+;(4)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩,冷却结晶、过滤、洗涤、干燥得到晶体,
所以答案是:冷却结晶;过滤;(5)依据图表物质的溶解度分析对比,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl;说明K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小),所以答案是:K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小);(6)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是先利用氢氧化铝的两性,用氢氧化钠溶液溶解氢氧化铝过滤得到滤液中通入二氧化碳生成氢氧化铝沉淀,灼烧干燥得到氧化铝干燥固体m g,依据铝元素守恒计算,样品中氢氧化铝的质量分数= ![]() ×100%=
×100%= ![]() ,
,
所以答案是:NaOH溶液;通入过量二氧化碳; ![]() .
.