题目内容
【题目】下列反应最终一定有+3价铁生成的是( )
①过量的Fe与![]() 反应 ②Fe与过量稀硫酸反应后,再向其中加
反应 ②Fe与过量稀硫酸反应后,再向其中加![]() ③
③![]() 溶液中加少量盐酸 ④把Fe和
溶液中加少量盐酸 ④把Fe和![]() 的混合物溶于盐酸中
的混合物溶于盐酸中
A.只有① B.只有①② C.只有①②③ D.全部
【答案】C
【解析】
试题分析:①过量的Fe与![]() 反应产生FeCl3,正确;②Fe与过量稀硫酸反应产生FeSO4,再加入KNO3后,由于在酸性条件下Fe2+有还原性,会被NO3-氧化为Fe3+,正确;③
反应产生FeCl3,正确;②Fe与过量稀硫酸反应产生FeSO4,再加入KNO3后,由于在酸性条件下Fe2+有还原性,会被NO3-氧化为Fe3+,正确;③![]() 溶液中加少量盐酸,在酸性条件下Fe2+有还原性,会被NO3-氧化为Fe3+,正确;④把Fe和
溶液中加少量盐酸,在酸性条件下Fe2+有还原性,会被NO3-氧化为Fe3+,正确;④把Fe和![]() 的混合物溶于盐酸中,若Fe过量则在溶液中只有FeCl2,若Fe不足量,则可能既有FeCl3也有FeCl2,错误。故选项是C。
的混合物溶于盐酸中,若Fe过量则在溶液中只有FeCl2,若Fe不足量,则可能既有FeCl3也有FeCl2,错误。故选项是C。

【题目】铬铁矿的主要成分可表示为FeOCr2O3 , 还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图: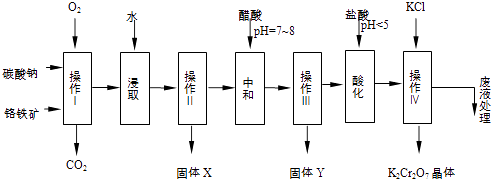
已知:
①4FeOCr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3 ![]() 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
根据题意回答下列问题:
(1)操作I在常温下该反应速度极慢,下列措施中能使反应速率增大的是 .
A.升高温度
B.通入过量的空气
C.将原料粉碎
D.增加纯碱的用量
(2)固体X中主要含有(填写化学式);
(3)酸化步骤用盐酸调节溶液pH<5,并煮沸其目的是 . (离子方程式表示)
(4)操作 iv有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、、、洗涤、干燥.
(5)表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.该反应在溶液中能发生的理由是 . (文字说明)
物质 | 溶解度/(g/100g水) | ||
0°C | 40°C | 80°C | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
(6)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量(填写试剂)、溶解、过滤、再(填写试剂)、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为(用含m、n的代数式表示).
【题目】25℃时,三种难溶银盐的Ksp与颜色如表,下列说法正确的是( )
AgCl | Ag2CrO4 | AgI | |
颜色 | 白 | 砖红 | 黄 |
Ksp | 1.8×10﹣10 | 1.0×10﹣12 | 8.5×10﹣17 |
A.AgCl、Ag2CrO4、AgI饱和溶液中c(Ag+)依次减弱
B.Ag2CrO4饱和溶液中c(Ag+)约为1.0×10﹣6molL﹣1
C.向AgCl悬浊液加入足量KI溶液,沉淀将由白色转化为黄色
D.向等浓度的KCl与K2CrO4混合溶液中滴加少量AgNO3溶液,将生成砖红色沉淀