题目内容
【题目】海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水中制得的氯化钠可用于生产烧碱及氯气。反应的离子方程式是 。
![]()
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
将Br2与Na2CO3反应的化学方程式补充完整:
![]()
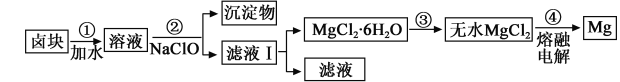
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):
生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH) 2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是 。
② 用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是 。
③ 步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因____________。
④ NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。除去0.1mol CO(NH2)2时消耗NaClO g。
【答案】(1)2Cl—+2H2O![]() Cl2↑+H2↑+2OH—;
Cl2↑+H2↑+2OH—;
(2)3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2;
(3)①除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去;
②ClO—+2Fe2++5H2O=2Fe(OH)3+Cl—+4H+;
③Mg2++2H2O![]() Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解,HCl还能带出水份,最终得到无水MgCl2;④22.35。
Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解,HCl还能带出水份,最终得到无水MgCl2;④22.35。
【解析】
试题分析:(1)制备烧碱,常电解饱和食盐水,因此离子反应方程式为:2Cl— +2H2O![]() Cl2 ↑+H2 ↑+ 2OH—;(2)Br2在此反应中既做氧化剂又做还原剂,Br2→NaBrO3,化合价升高5价,必然有化合价降低,Br2→NaBr化合价降低1价,最小公倍数为5,因此反应方程式为3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2;(3)①根据生成氢氧化物沉淀的pH,当pH=9.8时,Fe3+、Fe2+、Mn2+全部转化成沉淀,因此目的是:除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去;②ClO-→Cl-化合价降低2价,Fe2+→Fe(OH)3化合价升高1价,最小公倍数2,因此离子反应方程式为ClO-+2Fe2++5H2O=Cl-+2Fe(OH)3↓+4H+;③Mg2+ +2H2O
Cl2 ↑+H2 ↑+ 2OH—;(2)Br2在此反应中既做氧化剂又做还原剂,Br2→NaBrO3,化合价升高5价,必然有化合价降低,Br2→NaBr化合价降低1价,最小公倍数为5,因此反应方程式为3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2;(3)①根据生成氢氧化物沉淀的pH,当pH=9.8时,Fe3+、Fe2+、Mn2+全部转化成沉淀,因此目的是:除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去;②ClO-→Cl-化合价降低2价,Fe2+→Fe(OH)3化合价升高1价,最小公倍数2,因此离子反应方程式为ClO-+2Fe2++5H2O=Cl-+2Fe(OH)3↓+4H+;③Mg2+ +2H2O![]() Mg(OH)2+2H+,温度升高,水解程度增大,通入 HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解 ,HCl还能带出水份,最终得到无水MgCl2 ;③根据信息,NaClO和CO(NH2)反应生成NaCl、N2和CO2,尿素中N被氧化成N2,其他元素化合价不变,根据得失电子数目守恒,0.1×2×3=m(NaClO)×2/74.5,m(NaClO)=22.35g。
Mg(OH)2+2H+,温度升高,水解程度增大,通入 HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解 ,HCl还能带出水份,最终得到无水MgCl2 ;③根据信息,NaClO和CO(NH2)反应生成NaCl、N2和CO2,尿素中N被氧化成N2,其他元素化合价不变,根据得失电子数目守恒,0.1×2×3=m(NaClO)×2/74.5,m(NaClO)=22.35g。

【题目】在花瓶中插上一束美丽的鲜花,将会给你紧张而又忙碌的学习、生活带来轻松和愉悦的心情。可是过不了几天,花儿就会枯萎。如果在花瓶中加入“鲜花保鲜剂”,就会延长鲜花的寿命。下表是1L“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成 分 | 质 量(g) | 摩尔质量(g/mol) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是_________(填字母)。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中的K+的物质的量浓度约为(阿司匹林中不含K+)_______
(3)配制上述1L“鲜花保鲜剂”所需的仪器有:量筒、烧杯、玻璃棒、托盘天平、药匙、___________________。(填所缺仪器的名称)。
(4)在溶液配制过程中,下列操作对配制结果没有影响的是______(填字母)。
A.定容用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度线相切
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(5)实验室用固体加热制氨气的化学反应方程式为:
__________________________________________________________
(6)若将收集到的氨气溶于水配成100 mL的溶液,所得氨水中NH3物质量浓度(不考虑NH3与H2O的反应)为0.3 mol·L-1,则需要氨气的体积为________mL(标
准状况)。