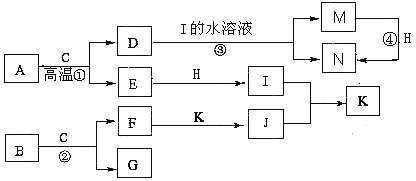
题目内容
【题目】对以下描述的解释或结论中,正确的是( )
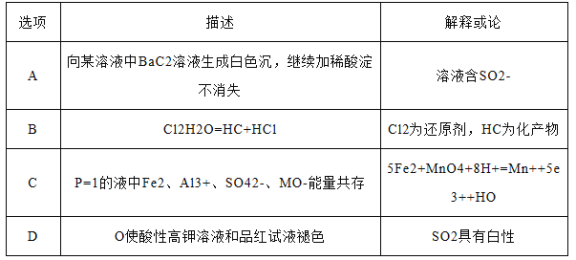
A. A B. B C. C D. D
【答案】C
【解析】试题分析:A、不溶于稀硝酸的沉淀一般是BaSO4、AgCl、AgBr、AgI等,因此溶液中可能含有Ag+,也可能含有SO42-,故错误;B、氯气和水反应,氯气既是氧化剂又是还原剂,HCl是还原产物,HClO是氧化产物,故错误;C、MnO4-具有强氧化性,能把Fe2+氧化成Fe3+,本身被还原成Mn2+,根据化合价的升降法进行配平,离子反应是5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O,故正确;D、高锰酸钾具有强氧化性,能把SO2氧化成SO42-,SO2表现还原性,SO2能使品红溶液褪色,表现SO2的漂白性,故错误。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水中制得的氯化钠可用于生产烧碱及氯气。反应的离子方程式是 。
![]()
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
将Br2与Na2CO3反应的化学方程式补充完整:
![]()
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):

生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH) 2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是 。
② 用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是 。
③ 步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因____________。
④ NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。除去0.1mol CO(NH2)2时消耗NaClO g。