题目内容
1.下列反应的离子方程式书写正确的是( )| A. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑ | |
| C. | 向Al2(SO4)3溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
分析 A.次氯酸为弱电解质,应保留化学式;
B.电荷不守恒;
C.Al2(SO4)3溶液中加入过量的氨水,反应生成氢氧化铝和硫酸铵;
D.次氯酸根离子具有强的氧化性,能够氧化二氧化硫.
解答 解;A.氯气与水反应,离子方程式:Cl2+H2O═H++Cl-+HClO,故A错误;
B.金属铝溶于氢氧化钠溶液,离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑,故B错误;
C.向Al2(SO4)3溶液中加入过量的氨水,离子方程式:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故C正确;
D.向漂白粉溶液中通入少量SO2气体反应生成硫酸钙、氯化氢和次氯酸,离子方程式为:Ca2++3ClO-+SO2+H2O═CaSO4↓+Cl-+2HClO,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质和离子方程式书写方法是解题关键,注意化学式的拆分、原子个数、电荷数守恒,题目难度不大.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
11.下列哪组离子能在水溶液中大量共存( )
| A. | K+、CO32-、HS-、S2-、Al3+、AlO2- | B. | MnO4-、Na+、SO42-、K+、Cl- | ||
| C. | SO42-、Ag+、SO32-、S2-、AlO2-、K+ | D. | Fe3+、Cl-、H+、NO3- |
6.按要求填空:
(1)100mL 0.2mol/LAl2(SO4)3溶液中含SO42-0.06 mol,含Al3+的物质的量浓度0.4mol•L
(2)3mol O2与2mol O3质量之比为1:1,它们在同温同压下的体积比是3:2
(3)标准状况下,22.4mL氨气溶于水,配成1000mL溶液,问所得溶液的物质的量浓度0.001mol•L
(4)5.6g 硅单质与NaOH完全反应,问转移电子数为0.8mol
(5)要除去下列物质中少量杂质(括号内是杂质),应采取什么方法?写出有关反应的离子方程式:
(1)100mL 0.2mol/LAl2(SO4)3溶液中含SO42-0.06 mol,含Al3+的物质的量浓度0.4mol•L
(2)3mol O2与2mol O3质量之比为1:1,它们在同温同压下的体积比是3:2
(3)标准状况下,22.4mL氨气溶于水,配成1000mL溶液,问所得溶液的物质的量浓度0.001mol•L
(4)5.6g 硅单质与NaOH完全反应,问转移电子数为0.8mol
(5)要除去下列物质中少量杂质(括号内是杂质),应采取什么方法?写出有关反应的离子方程式:
| 物质 | 所加试剂(填化学式) | 离子方程式 |
| ①Mg(OH)2(Al(OH)3) | ||
| ②NaHCO3溶液(Na2CO3) | ||
| ③FeCl2溶液(FeCl3) |
13.烃分子中若含有双键、三键或单键的环,氢原子数就少,分子就不饱和,即具有一定的“不饱和度”,其数值可表示为:不饱和度(Ω)=双键数+环数+三键数×2.则有机物 的不饱和度Ω为( )
的不饱和度Ω为( )
 的不饱和度Ω为( )
的不饱和度Ω为( )| A. | 8 | B. | 7 | C. | 6 | D. | 5 |
10.在短周期元素中,原子最外电子层只有1个或2个电子的元素是( )
| A. | 金属元素 | B. | 非金属元素 | ||
| C. | 稀有气体元素 | D. | 无法确定为哪一类元素 |
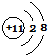 .D在周期表中位置第三周期第ⅥA族.
.D在周期表中位置第三周期第ⅥA族.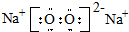 .
. 的名称为3,3,6-三甲基辛烷;
的名称为3,3,6-三甲基辛烷;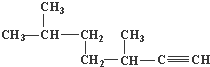 的名称为3,6-二甲基-1-庚炔;
的名称为3,6-二甲基-1-庚炔; ;
;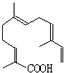 所示,分子式为C15H22O2;该物质可以与下列ABCD(填序号)发生反应.
所示,分子式为C15H22O2;该物质可以与下列ABCD(填序号)发生反应. 中含有的官能团的名称为羟基,酯基.
中含有的官能团的名称为羟基,酯基. .
.