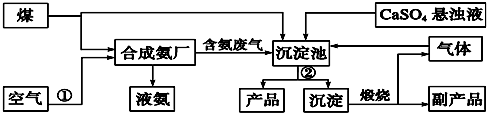
题目内容
6.按要求填空:(1)100mL 0.2mol/LAl2(SO4)3溶液中含SO42-0.06 mol,含Al3+的物质的量浓度0.4mol•L
(2)3mol O2与2mol O3质量之比为1:1,它们在同温同压下的体积比是3:2
(3)标准状况下,22.4mL氨气溶于水,配成1000mL溶液,问所得溶液的物质的量浓度0.001mol•L
(4)5.6g 硅单质与NaOH完全反应,问转移电子数为0.8mol
(5)要除去下列物质中少量杂质(括号内是杂质),应采取什么方法?写出有关反应的离子方程式:
| 物质 | 所加试剂(填化学式) | 离子方程式 |
| ①Mg(OH)2(Al(OH)3) | ||
| ②NaHCO3溶液(Na2CO3) | ||
| ③FeCl2溶液(FeCl3) |
分析 (1)硫酸铝完全电离,硫酸根浓度为硫酸铝的3倍;溶液是均匀的,取出溶液浓度与原溶液浓度相同,根据n=cV计算硫酸根物质的量,溶液中c(Al3+)=2c[Al2(SO4)3];
(2)根据公式m=nM,V=nVm计算;
(3)首先根据n=$\frac{V}{V{m}_{\;}}$计算HCl的物质的量,进而根据c=$\frac{n}{V}$计算物质的量浓度;
(4)根据Si+2NaOH+H2O═Na2SiO3+2H2↑;
(5)Al(OH)3与NaOH生成偏铝酸钠,Mg(OH)2不反应;向Na2CO3中通入二氧化碳,会反应生成碳酸氢钠溶液;FeCl3 可与Fe反应生成FeCl2.
解答 解:(1)0.1L,1.0mol/LAl2(SO4)3溶液中,Al2(SO4)3的物质的量=0.1L×0.2mol/L=0.02mol,SO42-的物质的量为0.02mol×3=0.06mol,溶液中c(Al3+)=2c[Al2(SO4)3]=0.2mol/L×2=0.4mol/L,故答案为:0.06;0.4;
(2)3mol O2的质量=3mol×32g/mol=96g,2mol O3质量=2mol×48g/mol=96g,故3mol O2与2mol O3质量之比为1:1;
3mol O2的体积=3mol×Vm,2mol O3的体积=2mol×Vm,故3mol O2与2mol O3体积之比为3:2;
故答案为:1:1;3:2;
(3)标准状况下,n(NH3)=$\frac{V}{V{m}_{\;}}$=$\frac{0.0224L}{22.4L/mol}$=0.001mol,c(NH3)=$\frac{n}{V}$=$\frac{0.001L}{1L}$=0.001mol/L,故答案为:0.001;
(4)根据Si+2NaOH+H2O═Na2SiO3+2H2↑,5.6g硅的物质的量是0.2mol,方程式中反应1mol硅转移4mol电子,反应0.2mol硅转移0.8mol电子,故答案为:0.8;
(5)Al(OH)3与NaOH反应为Al(OH)3+NaOH=NaAlO2+2H2O,氢氧化铝、水在离子反应中应保留化学式,则该离子反应为Al(OH)3+OH-=AlO2-+2H2O;向Na2CO3中通入二氧化碳,会反应生成碳酸氢钠溶液,达到除杂的目的,CO2+H2O+CO32-=2HCO3-;Fe与氯化铁反应生成氯化亚铁,且Fe不能溶于水,选Fe来除杂,发生的离子反应为Fe+2Fe3+═3Fe2+,故答案为:
| 物质 | 所加试剂(填化学式) | 离子方程式 |
| ①Mg(OH)2(Al(OH)3) | NaOH | Al(OH)3+OH-=AlO2-+2H2O |
| ②NaHCO3溶液(Na2CO3) | CO2 | CO32-+H2O+CO2=2H CO3- |
| ③FeCl2溶液(FeCl3) | Fe | Fe+2Fe3+=3 Fe2+ |
点评 本题考查物质的量浓度的计算、除杂及离子反应方程式的书写,为高考常见题型,注意除杂的原则及物质的性质即可解答,侧重氧化还原反应的考查,题目难度不大.

| A. | 煤的干馏是物理变化 | |
| B. | 液化石油气和天然气的主要成分都是碳氢化合物 | |
| C. | 石油裂化得到的汽油是纯净物 | |
| D. | 煤的气化和石油的分馏都是物理变化 |
| A. | 此电池能发生蓝色火焰 | |
| B. | H2为正极,O2为负极 | |
| C. | 工作时,电解质溶液的pH不断减小 | |
| D. | 电极反应分别为负极:2H2+4 OH--4e-=4 H2O;正极:O2+2 H2O+4e-=4 OH- |
| A. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑ | |
| C. | 向Al2(SO4)3溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
| A. | CH3Cl | B. | 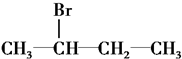 | ||
| C. | 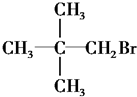 | D. | 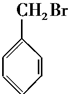 |
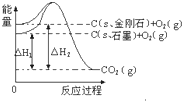
| A. | C(s石墨)=C(s金刚石)△H=+1.9 kJ•mol-1 | |
| B. | 金刚石的稳定性大于石墨 | |
| C. | 石墨和金刚石转化是物理变化 | |
| D. | 1 mol石墨本身具有的总能量比1 mol金刚石本身具有的总能量大1.9 kJ |
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg Al | 稀盐酸 | 偏向Al |
| 2 | Al Cu | 稀盐酸 | 偏向Cu |
| 3 | Al 石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg Al | NaOH溶液 | 偏向Mg |
| 5 | Al Cu | 浓硝酸 | 偏向Al |
(1)实验1、2的Al所作的电极分别是D
A.负极,负极 B.正极,正极 C.负极,正极 D.正极,负极
(2)写出实验5中的电极反应式和电池总反应方程式.
负极Cu-2e-=Cu2+;
正极4H++2NO3-+2e-=2NO2↑+2H2O;
电池总反应离子方程式:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.