题目内容
11.应用元素周期律的有关知识,可以预测我们不熟悉的一些元素的单质及其化合物的性质.下列预测中正确的是( )①Be的氧化物的水化物可能具有两性
②第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
③At单质为有色固体,AgAt不溶于水也不溶于稀硝酸
④Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
⑤SrSO4是难溶于水的白色固体
⑥H2Se是无色、有毒、比H2S稳定的气体.
| A. | ①②③④ | B. | ②④⑥ | C. | ①③⑤ | D. | ②④⑤ |
分析 ①根据元素周期表中对角线规则知处于对角线的元素具有相似性;
②氨气溶于水显碱性;
③卤族元素单质从上到下,单质由气体过渡为固体,颜色逐渐加深,AgAt具有AgCl的相似的性质;
④Li燃烧生成Li2O,碱金属从上到下,金属性增强,最高价氧化物对应水化合物碱性增强;
⑤同主族元素化合物的性质具有相似性和递变性;
⑥元素的非金属性越强,其氢化物的稳定性越强.
解答 解:①元素周期表中Be和Al处于对角线位置上,处于对角线的元素具有相似性,所以Be的氧化物的水化物可能具有两性,故①正确;
②第二周期非金属元素的气态氢化物中氨气溶于水显碱性,甲烷难溶于水,故②错误;
③卤族元素单质从上到下,单质由气体过渡为固体,颜色逐渐加深,AgAt具有AgCl的相似的性质,不溶于水也不溶于稀硝酸,故③正确;
④Li燃烧生成Li2O,从上到下,金属性增强,则LiOH为弱碱,故④错误;
⑤第ⅡA元素硫酸盐性质的递变规律,硫酸钡(BaSO4)是难溶于水的白色固体,则硫酸锶(SrSO4)是难溶于水的白色固体,故⑤正确;
⑥非金属性越强,气态氢化物越稳定,非金属性:S>Se,则氢化物稳定性为:H2S>H2Se,故⑥错误;
所以正确的有①③⑤;
故选C.
点评 本题考查同主族元素和同周期元素的性质变化规律以及对角线原则,为高频考点,侧重于基础知识的考查,题目难度不大,注意把握元素规律的运用.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案
相关题目
1.下列反应的离子方程式书写正确的是( )
| A. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑ | |
| C. | 向Al2(SO4)3溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
2.Y元素的阳离子和X元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是( )
| A. | Y的原子序数比X的小 | B. | Y的原子半径比X的大 | ||
| C. | Y原子的最外层电子数比X的大 | D. | Y元素的最高正价比X的大 |
19.下列叙述正确的是( )
| A. | 原子晶体中只存在非极性共价键 | |
| B. | 甲烷?氨和水都是由极性键结合而成的极性分子 | |
| C. | 金属晶体的熔点一定比原子晶体低,比分子晶体高 | |
| D. | H2O的沸点比H2S高,是因为H2O分子间存在氢键 |
6.下列说法正确的是( )
| A. | 可以用澄清石灰水鉴别SO2和CO2 | |
| B. | 硫粉在过量的纯氧中燃烧可以生成SO3 | |
| C. | SO2能使溴水、酸性KMnO4溶液褪色 | |
| D. | 少量SO2通过浓的氯化钙溶液能生成白色沉淀 |
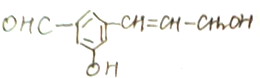
3. 某有机化合物的结构简式如下:此有机化合物属于( )
某有机化合物的结构简式如下:此有机化合物属于( )
①烯烃 ②多官能团有机化合物
③芳香烃 ④烃的衍生物.
 某有机化合物的结构简式如下:此有机化合物属于( )
某有机化合物的结构简式如下:此有机化合物属于( )①烯烃 ②多官能团有机化合物
③芳香烃 ④烃的衍生物.
| A. | ①②③④ | B. | ②④ | C. | ②③ | D. | ①③ |
20.对有机物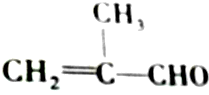 的化学性质叙述错误的是( )
的化学性质叙述错误的是( )
 的化学性质叙述错误的是( )
的化学性质叙述错误的是( )| A. | 既能发生氧化反应,又能发生还原反应 | |
| B. | 1 mol该物质只能与1 mol Br2发生加成反应 | |
| C. | 能发生加聚反应 | |
| D. | 能将新制的Cu(OH)2氧化 |
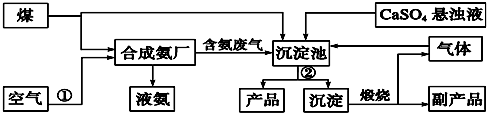
 在下列反应中生成的有机物的结构简式.
在下列反应中生成的有机物的结构简式.