题目内容
10.在短周期元素中,原子最外电子层只有1个或2个电子的元素是( )| A. | 金属元素 | B. | 非金属元素 | ||
| C. | 稀有气体元素 | D. | 无法确定为哪一类元素 |
分析 短周期元素中,H、Li、Na的最外层电子数为1,Be、Mg及稀有气体He的最外层有2个电子,以此来解答.
解答 解:短周期元素中,最外层电子数是1个有:第一主族元素(包含H元素,碱金属元素);最外层有2个的元素有第二主族元素(碱土金属元素)、稀有气体元素中的He元素,
H、He为非金属元素,Li、Na、Mg为金属元素,
故选D.
点评 本题考查元素周期表的结构及应用,为高频考点,把握原子结构与元素位置的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
20.下列说法中,正确的是( )
| A. | 双原子分子中的共价键,一定是非极性键 | |
| B. | 任何原子的原子核都是由质子和中子构成的 | |
| C. | 非极性键也可能存在于离子化合物中 | |
| D. | BF3和CS2分子中所有原子的最外层都是8电子稳定结构 |
1.下列反应的离子方程式书写正确的是( )
| A. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑ | |
| C. | 向Al2(SO4)3溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
18.如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )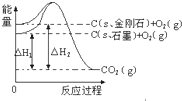

| A. | C(s石墨)=C(s金刚石)△H=+1.9 kJ•mol-1 | |
| B. | 金刚石的稳定性大于石墨 | |
| C. | 石墨和金刚石转化是物理变化 | |
| D. | 1 mol石墨本身具有的总能量比1 mol金刚石本身具有的总能量大1.9 kJ |
15.某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
根据上表中的实验现象完成下列问题:
(1)实验1、2的Al所作的电极分别是D
A.负极,负极 B.正极,正极 C.负极,正极 D.正极,负极
(2)写出实验5中的电极反应式和电池总反应方程式.
负极Cu-2e-=Cu2+;
正极4H++2NO3-+2e-=2NO2↑+2H2O;
电池总反应离子方程式:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg Al | 稀盐酸 | 偏向Al |
| 2 | Al Cu | 稀盐酸 | 偏向Cu |
| 3 | Al 石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg Al | NaOH溶液 | 偏向Mg |
| 5 | Al Cu | 浓硝酸 | 偏向Al |
(1)实验1、2的Al所作的电极分别是D
A.负极,负极 B.正极,正极 C.负极,正极 D.正极,负极
(2)写出实验5中的电极反应式和电池总反应方程式.
负极Cu-2e-=Cu2+;
正极4H++2NO3-+2e-=2NO2↑+2H2O;
电池总反应离子方程式:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
2.Y元素的阳离子和X元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是( )
| A. | Y的原子序数比X的小 | B. | Y的原子半径比X的大 | ||
| C. | Y原子的最外层电子数比X的大 | D. | Y元素的最高正价比X的大 |
19.下列叙述正确的是( )
| A. | 原子晶体中只存在非极性共价键 | |
| B. | 甲烷?氨和水都是由极性键结合而成的极性分子 | |
| C. | 金属晶体的熔点一定比原子晶体低,比分子晶体高 | |
| D. | H2O的沸点比H2S高,是因为H2O分子间存在氢键 |
20.对有机物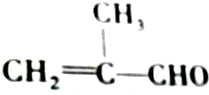 的化学性质叙述错误的是( )
的化学性质叙述错误的是( )
 的化学性质叙述错误的是( )
的化学性质叙述错误的是( )| A. | 既能发生氧化反应,又能发生还原反应 | |
| B. | 1 mol该物质只能与1 mol Br2发生加成反应 | |
| C. | 能发生加聚反应 | |
| D. | 能将新制的Cu(OH)2氧化 |
 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: