题目内容
【题目】热化学方程式中的ΔH实际上是热力学中的一个物理量,叫做焓变,其数值和符号与反应物和生成物的总能量有关,也与反应物和生成物的键能有关。
(1)已知反应CH3—CH3(g) → CH2=CH2(g)+H2(g),有关化学键键能如下。
化学键 | C—H | C=C | C—C | H—H |
键能/kJ·mol-1 | 414.4 | 615.3 | 347.4 | 435.3 |
试计算该反应的反应热___________________________
(2)已知H2(g)+Br2(l)=2HBr(g);ΔH=-72 kJ/mol。蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其它相关数据如下表:
H2(g) | Br2(g) | HBr(g) | |
1 mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | a | 369 |
则表中a为__________
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行理论推算。试依据下列热化学方程式,计算反应
2C(s)+2H2(g)+O2(g)=CH3COOH(l)的焓变ΔH=________。
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+1/2O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1
(4)如下图Ⅰ所示表示的是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:___________________________________________________________________。
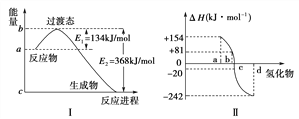
(5)图Ⅱ表示氧族元素中的氧、硫、硒(Se)、碲(Te)在生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢发生分解反应的热化学方程式:_____________________。
(6)已知:
①Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g);ΔH=-25 kJ·mol-1,
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g);ΔH=-47 kJ·mol-1,
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g);ΔH=+19 kJ·mol-1
请写出CO还原FeO的热化学方程式:__________________________。
(7) 火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。热化学方程式为:N2H4(l) + 2H2O2(l) == N2(g) + 4 H2O(g) △ H=-644.25 kJ/molspan>。又已知H2O (l) == H2O (g) ΔH=+ 44 kJ/mol。则64g液态肼
与液态双氧水反应生成液态水时放出的热量是 _________________ kJ。
(8)焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l) ΔH3=-545 kJ·mol-1。
则SO3(g)与H2O(l)反应的热化学方程式是___________________。
【答案】 +125.6 kJ·mol-1 200 -488.3 kJ·mol-1 NO2(g)+CO(g)===NO(g)+CO2(g);ΔH=-234 kJ·mol-1 H2Se(g)===Se(g)+H2(g);ΔH=-81 kJ/mol FeO(s)+CO(g)===Fe(s)+CO2(g);ΔH=-11 kJ·mol-1 1640.5 SO3(g)+H2O(l)===H2SO4(l) ΔH=-130 kJ·mol-1
【解析】(1)在反应CH3-CH3→CH2=CH2+H2中,断裂6mol C-H键,1mol C-C键共吸收的能量为:6×414.4kJ+347.4kJ=2833.8kJ,生成1molCH2=CH2和1molH2,共形成4molC-H键,1molC=C、1molH-H,共放出的能量为:4×414.4kJ+615.3kJ+435.3kJ=2708.2kJ,吸收的能量多,放出的能量少,该反应为吸热反应,吸收的热量为:2833.8kJ-2708.2kJ=125.6 kJ,所以反应热为+125.6kJ/mol,故答案为:+125.6kJ/mol;
(2)在H2(g)+Br2(l)=2HBr(g)△H=-72kJ/mol反应中,1 mol Br2(l)需要吸收的能量为30 kJ,即Br2(g)=Br2(l)△H=-30kJ/mol,则H2(g)+Br2(g)=2HBr(g)△H=-102kJ/mol,反应热等于反应物的总键能减生成物的总键能,则△H=-102=436+a-2×369,a=200,故答案为:200;
(3) ①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)ΔH1=-870.3 kJ·mol-1,②C(s)+O2(g)=CO2(g)ΔH2=-393.5 kJ·mol-1,③H2(g)+1/2O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1,根据盖斯定律,将②×2+③×2-①得:2C(s)+2H2(g)+O2(g)=CH3COOH(l) ΔH=(-393.5 kJ·mol-1)×2+(-285.8 kJ·mol-1)×2-(-870.3 kJ·mol-1)=-488.3 kJ·mol-1,故答案为:-488.3 kJ·mol-1;
(4)该反应的焓变△H=E1-E2=134kJ/mol-368kJ/mol=-234kJ/mol,所以热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJmol-1,故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJmol-1;
(5)非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而根据热力学,能量越低越稳定,a、b、c、d依次为H2Te、H2Se、H2S、H2O;b为硒化氢的生成热数据,则硒化氢分解放热,且△H=-81kJ/mol,所以H2Se发生分解反应的热化学反应方程式为H2Se(g)=Se(s)+H2(g) △H=-81kJ/mol,故答案为:H2Se(g)=Se(s)+H2(g) △H=-81kJ/mol;
(6)①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),△H1=-25kJ/mol,②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g),△H2=-47kJ/mol,③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g),△H3=19kJ/mol,根据盖斯定律将方程式变形(3×①-②-2×③)×![]() 得:Fe(s)+CO(g)═Fe(s)+CO2(g),△H=(3×△H1-△H2-2×△H3)×
得:Fe(s)+CO(g)═Fe(s)+CO2(g),△H=(3×△H1-△H2-2×△H3)×![]() =-11kJ/mol,故答案为:Fe(s)+CO(g)═Fe(s)+CO2(g)△H=-11kJ/mol;
=-11kJ/mol,故答案为:Fe(s)+CO(g)═Fe(s)+CO2(g)△H=-11kJ/mol;
(7)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-644.25kJ/mol;②H2O(l)=H2O(g)△H=+44kJ/mol;依据盖斯定律①-②×4span>得到N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-820.75kJ/mol:则64g液态肼物质的量=![]() =2mol;与液态双氧水反应生成液态水时放出的热量1640.5kJ,故答案为:1640.5kJ;
=2mol;与液态双氧水反应生成液态水时放出的热量1640.5kJ,故答案为:1640.5kJ;
(8)2SO2(g)+O2(g)2SO3(g)△H1=一197kJ/mol ①,H2O (g)=H2O(1)△H2=一44kJ/mol ②,2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol③,利用盖斯定律:(③-①-②×2)÷2 得SO3 (g)+H2O(l)=H2SO4(l)△H=-130kJ/mol,故答案为:SO3 (g)+H2O(l)=H2SO4(l)△H=-130kJ/mol。