题目内容
【题目】实验室用图装置制取氯气,并进行相关性质的实验。
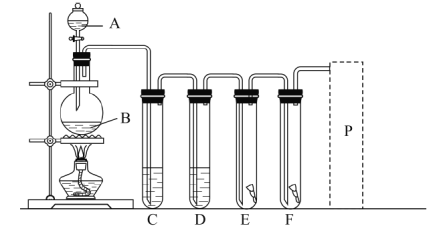
(1)A、B两仪器的名称:A________、B________。
(2)写出实验室用此装置制取氯气的化学方程式________。
(3)为了得到纯净干燥的氯气,写出装置C、D中应该加入的药品的名称:C____、D_________。
(4)E中放入红色干布条,F中放入红色湿布条。可观察到的现象是________,写出发生反应的化学方程式________。
(5)P处为尾气处理装置,画出装置图,标出所用的药品。________

(6)NaClO是“84”消毒液的有效成分。请回答下列问题。
①NaClO中Cl元素的化合价是______。
②用氢氧化钠溶液和氯气反应制备“84”消毒液,反应的离子方程式是_______。
③若将“84”消毒液与洁厕灵(主要成分是盐酸)混合使用,则会产生黄绿色的有毒气体,其反应的离子方程式是_________。
(7)FeCl3在现代工业中应用广泛,某化学研究性学习小组模拟工业生产流程制备无水FeCl3。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华,无水CaCl2是常用的干燥剂。他们设计了制备无水FeCl3的实验方案,装置示意如图(加热、加持及尾气处理装置略去)及操作步骤如下:
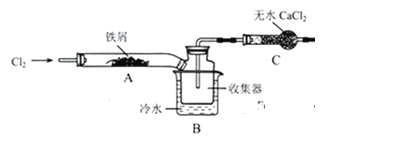
①检查装置气密性
②通入干燥的氯气,赶尽装置内的空气
③用酒精灯在铁屑下方加热至反应完成
④……
⑤体系冷却后,停止通入氯气,并用干燥的的氮气赶尽氯气,将收集器密封。
请回答下列问题:
①装置A中发生反应的化学方程式_____________。
②步骤③加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A的右端。要使沉积的FeCl3进入收集器,第④步操作是________。
③操作步骤中,为防止潮解所采取的措施有(填步骤序号)________。
④装置B中的冷却水作用为________。
【答案】分液漏斗 圆底烧瓶 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 饱和食盐水 浓H2SO4 E中无变化;F中红色布条褪色 Cl2+H2O=HCl+HClO
MnCl2+Cl2↑+2H2O 饱和食盐水 浓H2SO4 E中无变化;F中红色布条褪色 Cl2+H2O=HCl+HClO  +1 Cl2+2OH-=Cl-+ClO-+H2O Cl-+ClO-+2H+=Cl2↑+H2O 2Fe+3Cl2
+1 Cl2+2OH-=Cl-+ClO-+H2O Cl-+ClO-+2H+=Cl2↑+H2O 2Fe+3Cl2![]() 2FeCl3 在沉积的FeCl3固体下方加热 ②⑤ 冷却,使FeCl3沉积,便于收集产品
2FeCl3 在沉积的FeCl3固体下方加热 ②⑤ 冷却,使FeCl3沉积,便于收集产品
【解析】
在分液漏斗在放入浓盐酸,在烧瓶中放入MnO2,二者在加热条件下反应产生Cl2,浓盐酸具有挥发性,制取的Cl2中含有杂质HCl、H2O蒸气,先通过C装置的饱和NaCl溶液除去HCl,然后通过D装置的浓硫酸干燥气体,得到干燥纯净的Cl2,将Cl2先通过干燥的有色布条不褪色,再通入潮湿的布条,会看到布条褪色,证明Cl2不具有漂白性,氯气与水反应的产物具有漂白性。Cl2与Fe在加热条件下反应产生FeCl3,FeCl3容易潮解,因此反应在无水条件下进行,最后通过NaOH溶液进行尾气处理然后排放。
(1)通过装置图可知A是分液漏斗,B是圆底烧瓶;
(2)在实验室中用浓盐酸与MnO2混合加热制取Cl2,反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(3)用上述方法制取的氯气中含有杂质HCl、H2O蒸气,先通过饱和NaCl溶液除去杂质HCl,然后通过浓硫酸干燥Cl2,就得到干燥的纯净的Cl2;
(4)E中放入红色干布条,F中放入红色湿布条。可观察到的现象是E中无变化,F中红色布条褪色,发生反应的化学方程式为Cl2+H2O=HCl+HClO;
(5)Cl2是有毒气体,不能直接排放,可根据Cl2能够与NaOH溶液反应Cl2+2NaOH =NaCl+NaClO+H2O的性质,用NaOH溶液进行尾气处理,装置图为: ;
;
(6)①根据化合物在元素化合价代数和等于0,Na是+1价,O是-2价,所以NaClO中Cl元素化合价为+1价;
②NaOH与Cl2反应产生NaCl、NaClO、H2O,NaClO是84消毒液的主要成分,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
③浓盐酸与NaClO在酸性条件下会发生氧化还原反应产生Cl2,离子方程式为:Cl-+ClO-+2H+=Cl2↑+H2O;
(7)①氯气具有强氧化性,将变价铁氧化成高价铁,生成氯化铁,所以装置A中铁与氯气反应生成氯化铁,反应为2Fe+3Cl2![]() 2FeCl3;
2FeCl3;
②第③步加热后,生成的烟状FeCl3大部分进入收集器,第④步操作可根据FeCl3加热易升华的性质,对有少量沉积FeCl3的装置部位加热,FeCl3发生升华,从而使沉积的FeCl3进入收集器;
③为防止FeCl3潮解所采取的措施有:②通入干燥的Cl2;⑤用干燥的N2赶尽Cl2,故合理选项是②⑤;
④B中的冷水作用为是冷却FeCl3使其沉积,便于收集产品。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
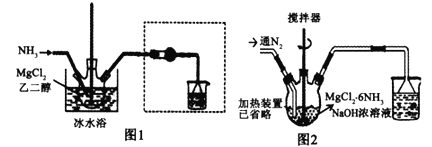
小学生10分钟应用题系列答案【题目】已知MgCl2+6NH3![]() MgCl2·6NH3该反应具有极好的可逆吸、放氨特性。某课题组在实验室探究其特性,其中氨化(吸氨)过程实验装置如图1,放氨过程实验装置如图2。
MgCl2·6NH3该反应具有极好的可逆吸、放氨特性。某课题组在实验室探究其特性,其中氨化(吸氨)过程实验装置如图1,放氨过程实验装置如图2。
己知:相关物质的性质见下表
物质名称 | 氨气的溶解性 | 氯化镁的溶解性 | 六氨氯化镁的溶解性 |
水 | 易溶 | 易溶 | 易溶 |
甲醇(沸点65。C) | 易溶 | 易溶 | 难溶 |
乙二醇(沸点197。C) | 易溶 | 易溶 | 难溶 |
请回答:
(1)实验室采用固固加热的方式制备NH3,制备反应的方程式为___________,虚框内装置的作用是___________,氨化过程采用冰水浴的原因可能是_____(填选项序号字母)。
A.氨化过程为吸热反应,促进反应正向进行
B.加快反应速率
C.防止氨气从溶液中挥发,提高氨气利用率
D.增大六氨氯化镁的溶解度
(2)利用MgCl2溶液制备无水MgCl2,其具体操作为______________________。
(3)进行放氨实验时,三颈烧瓶加入1.97 g MgCl2·6NH3和烧碱的浓溶液,加热,并不断通入N2,通入N2目的是___________。通过观察烧杯中现象的变化就可以监控MgCl2·6NH3的放氨过程,若要判断转化率是否达到或超过90%,则烧杯中溶液可以是___________。