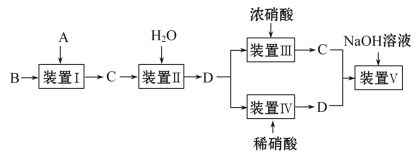
题目内容
【题目】氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下反应:2KNO3+3C+S=K2S+N2↑+3CO2↑。其中被氧化的元素是____________,还原产物是____________。
(2)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为4CuI+Hg=Cu2HgI4+2Cu。
①上述反应产物Cu2HgI4中,Cu元素显________价。
②以上反应中的氧化剂为________,当有1 mol CuI参与反应时,转移电子________mol。
③标明上述反应电子转移的方向和数目。____________________________。
(3)工业上常用酸性高锰酸钾溶液处理含有CuS和Cu2S的矿物,其反应原理如下:
8MnO4—+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4—+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
根据上述反应原理,某学习小组用400 mL 0.075 mol·L-1的酸性高锰酸钾溶液处理2 g含有CuS和Cu2S的混合物。反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1的(NH4)2Fe(SO4)2溶液完全反应。
①配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:______,MnO![]() +Fe2++H+=Mn2++Fe3++H2O
+Fe2++H+=Mn2++Fe3++H2O
②KMnO4溶液与固体混合物反应后,剩余KMnO4的物质的量为________ mol。
【答案】C K2S和N2 +1 CuI 0.5 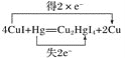 1 5 8 1 5 4 0.007
1 5 8 1 5 4 0.007
【解析】
(1)氧化还原反应反应中,氧化剂中元素的化合价降低,发生还原反应,对应产物为还原产物;还原剂中元素化合价升高,发生氧化反应,对应产物为氧化产物;据以上分析解答。
(2)反应4CuI+Hg=Cu2HgI4+2Cu中,铜元素的化合价由+1价降到0价,所以CuI做氧化剂;汞元素的化合价由0价升高到+2价,汞做还原剂;该反应共转移2e-电子,据此标出电子转移的方向和数目,并根据2e--4CuI关系进行计算;
(3)①根据氧化还原反应中电子守恒、电荷守恒、原子守恒进行配平;
②设与(NH4)2Fe(SO4)2反应消耗高锰酸钾xmol,根据反应MnO4-+5Fe2++8H+===Mn2++5Fe3++4H2O列方程进行计算。
(1)本反应中,氮元素的化合价由+5价变为0价,硫元素的化合价由0价变为-2价,碳元素的化合价由0价变为+4价,被氧化的元素是C。氧化剂是KNO3和S,氧化产物是CO2,还原产物是K2S和N2。
综上所述,本题答案是:C,K2S和N2。
(2)①I元素的负价只有-1价,Cu在化合物中只有+1、+2价,再由化学式中各元素正负化合价代数和等于零确定各元素的化合价,由此可确定Cu2HgI4中Cu为+1价,Hg为+2价。
综上所述,本题答案是:+1。
②反应4CuI+Hg===Cu2HgI4+2Cu中,铜元素由+1价降到0价,发生还原反应,所以氧化剂为CuI;每4mol CuI参加反应转移电子2 mol,即当有1molCuI参加反应时,转移电子0.5 mol。
综上所述,本题答案是:CuI,0.5。
③反应4CuI+Hg===Cu2HgI4+2Cu中,1molHg参加反应转移电子2mol,所以该反应电子转移的方向和数目如下: ;
;
综上所述,本题答案是: 。
。
(3)①反应中Mn元素的化合价由+7降低到+2,Fe元素的化合价由+2升高到+3,由电子守恒、电荷守恒、原子守恒可知,离子反应为MnO4-+5Fe2++8H+===Mn2++5Fe3++4H2O。
综上所述,本题答案是:1 5 8 1 5 4。
②设与(NH4)2Fe(SO4)2反应消耗高锰酸钾xmol,则
MnO4-+5Fe2++8H+===Mn2++5Fe3++4H2O
1mol 5mol
xmol 0.350L×0.1mol·L-1
所以x=0.007,即与固体混合物反应后剩余KMnO4的物质的量为0.007 mol。
综上所述,本题答案是:0.007。

【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH) 2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
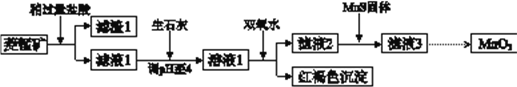
已知:生成氢氧化物沉淀的pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度为0.1 mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是_________。盐酸溶解MnCO3的化学方程式是_________。
(2)向溶液1中加入双氧水时,反应的离子方程式是___________。
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是__________。
(4)将MnCl2转化为MnO2的一种方法是氧化法。用酸化的NaClO3溶液将MnCl2氧化生成MnO2和Cl2,该反应的离子方程式为___________。
(5)将MnCl2转化为MnO2的另一种方法是电解法。
① 生成MnO2的电极反应式是___________。
② 若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2。检验Cl2的操作是_________。
③ 若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生。其原因是_________。