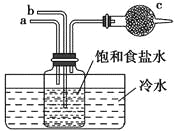
题目内容
【题目】“摩尔盐”是分析化学中的重要试剂,化学式为(NH4)2Fe(SO4)2·6H2O。“摩尔盐”在一定条件下分解的方程式为:4[(NH4)2Fe(SO4)2·6H2O] ![]() 2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:
2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:
(1)铁元素在元素周期表中的位置为_____,其价层电子排布图为________。
(2)组成“摩尔盐”的非金属元素中第一电离能最大的元素为________。“摩尔盐”的分解产物中属于非极性分子的化合物是________。
(3)NH3 的沸点比N2O 的沸点_____(填“高”或“低”),其主要原因是________________。
(4)K3[Fe(CN)6]常用于检验Fe2+,K3[Fe(CN)6]中除了离子键以外还存在的化学键为_______,与CN- 互为等电子体的单质的分子式为________。HCN 分子中σ键和π键的个数之比为________。
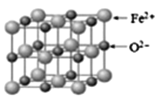
(5)FeO 晶胞结构如下图所示,FeO 晶体中Fe2+配位数为______,若该晶胞边长为acm,则该晶胞密度为________。
【答案】第四周期第Ⅷ族 ![]() N SO3 高 NH3分子间存在氢键 共价键和配位键 N2 1:1 6
N SO3 高 NH3分子间存在氢键 共价键和配位键 N2 1:1 6 ![]()
【解析】
(1)铁为26号元素,位于周期表中第四周期第VIII族,价电子排布式为3d64s2,则排布图为![]() ;
;
(2)组成“摩尔盐”的非金属元素为H、N、O、S,因N元素的2p能级为半充满状态,则第一电离能最大的为N;分解产物中的氮气是由非极性键构成的非极性单质,三氧化硫为极性键形成的非极性化合物;
(3)NH3分子间可形成氢键,而N2O分子间不存在氢键,则氨的沸点高于N2O;
(4)K3[Fe(CN)6]中K+与[Fe(CN)6]3-之间为离子键,Fe3+与CN-间为配位键,C与N之间为共价键;与CN-原子个数、价电子总数相等的分子为N2;HCN的结构式为H-C≡N,则σ键和π键各为2条,比值为1:1;
(5)由FeO晶胞结构可知,Fe2+在晶胞的顶点和面心,个数为8×1/8+6×1/2=4,O2-在晶胞的棱上和体心,个数为12×1/4+1=4,ρ=m/V=![]() g/cm3。
g/cm3。