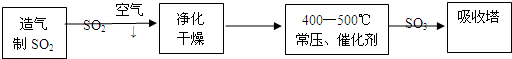
题目内容
将某黑色固体A加热至红热,放入热的浓H2SO4中,反应时放出的两种气体皆为酸性氧化物,反应的化学方程式为______,此反应证明浓H2SO4具有______性,若有agA参加反应,放出的气体在标况下占______L,转移的电子的物质的量是______;被还原H2SO4为______mol.
黑色固体与浓硫酸反应生成两种气体,应为C,加热条件下发生C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,反应中浓硫酸表现出强氧化性,
n(C)=
mol,则生成
molCO2,
molSO2,体积为(
mol+
mol)×22.4L/mol=5.6aL,
转移电子的物质的量为
mol×(4-0)=
mol,
被还原的硫酸为
mol×2=
mol,
故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;强氧化性;5.6;
mol;
.
| ||
n(C)=
| a |
| 12 |
| a |
| 12 |
| a |
| 6 |
| a |
| 12 |
| a |
| 6 |
转移电子的物质的量为
| a |
| 12 |
| a |
| 3 |
被还原的硫酸为
| a |
| 12 |
| a |
| 6 |
故答案为:C+2H2SO4(浓)
| ||
| a |
| 3 |
| a |
| 6 |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目