题目内容
【题目】2 mol A与2 mol B混合于2 L的密闭容器中,发生反应:2A(g)+3B(g) ![]() 2C(g)+zD(g),若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是
2C(g)+zD(g),若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是
A.v(C)=0.2 mol·L-1·s-1
B.z=3
C.B的转化率为25%
D.C平衡时的浓度为0.5 mol·L-1
【答案】D
【解析】
试题分析:2s后A的转化率为50%,则反应的A为2mol×50%=1mol,则
2A(g)+3B(g)![]() 2C(g)+zD(g)
2C(g)+zD(g)
开始(mol) 2 2 0 0
反应 1 1.5 1 0.5z
2s后 1 0.5 1 0.5z
v(C)=![]() =0.25molL-1s-1,故A错误;因反应速率之比等于化学计量数之比,由A可知,z=2,故B错误;B的转化率为
=0.25molL-1s-1,故A错误;因反应速率之比等于化学计量数之比,由A可知,z=2,故B错误;B的转化率为![]() ×100%=75%,故C错误;C平衡时的浓度=
×100%=75%,故C错误;C平衡时的浓度=![]() =0.5 mol·L-1,故D正确。
=0.5 mol·L-1,故D正确。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】汽车尾气中含有CO、NO等有害气体。

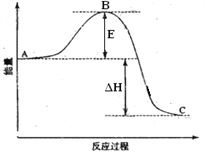
(1)汽车尾气中NO生成过程的能量变化示意图如图。该条件下,1molN2和1molO2完全反应生成NO会_______________(填“吸收”或“放出”)___________kJ能量。
(2)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:
①NiO电极上发生的是___________反应(填“氧化”或“还原”)。
②外电路中,电子流动方向是从_________电极流向_______电极(填“NiO”或“Pt”).
③Pt电极上的电极反应式为_______________________________。
(3)一种新型催化剂能使NO和CO发生反应:2NO+2CO![]() 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
实验编号 | t(℃) | NO初始浓度 | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.2×10﹣3 | 5.80×10﹣3 | 82 |
Ⅱ | 280 | 1.2×10﹣3 | b | 124 |
Ⅲ | 350 | a | 5.80×10﹣3 | 82 |
①请表中数据补充完整:a___________;b____________。
②能验证温度对化学反应速率规律的是实验____________________(填实验序号)。
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线________________(填“甲”或“乙”)。