��Ŀ����
����Ŀ���轺�ڸ���ʱ������Ȼ���(![]() )������ɫ�ı仯������ʪ������������ɫ��ת���dz��ɫ��ʹ�÷dz����㡣ijѧϰС�����ʵ���Ʊ��Ȼ��ܣ������ĵ��������ϣ����������ƣ��������ϼ�Ϊ+2��+3��������ϡ����(��Ӧ���������������������ſ�˳������)�����ڴ����м�����300����������CoO(�۵�Ϊ1 935��)��400��900������
)������ɫ�ı仯������ʪ������������ɫ��ת���dz��ɫ��ʹ�÷dz����㡣ijѧϰС�����ʵ���Ʊ��Ȼ��ܣ������ĵ��������ϣ����������ƣ��������ϼ�Ϊ+2��+3��������ϡ����(��Ӧ���������������������ſ�˳������)�����ڴ����м�����300����������CoO(�۵�Ϊ1 935��)��400��900������![]() ��
��
��ش��������⣺
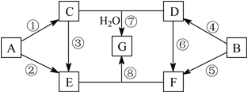
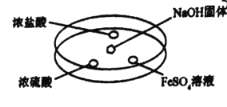
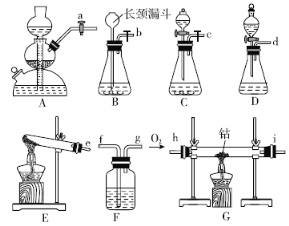
(1)ʵ��١������Ʊ��������Լ���ϣ���� A��E ��ѡ����ǡ��װ�÷���������С�
ʵ�� ��� | �� | �� | �� | �� |
�Լ� | H2O2 ��Һ | H2O2 ��Һ | KMnO4 ���� | H2O2��Һ |
���� | MnO2��ĩ | FeCl3��Һ | ��Al2O3Ϊ���壬����MnO2�Ŀ�״�� | |
װ�� | ____ | ____ | ____ | ____ |
(2)��һС�鸺���Ʊ���ˮCoO����ѡ��װ��C��Ϊ�����ķ���װ�ã����Ʊ�CoO����װ�õĽӿ�����˳��Ϊ___________��װ��C������Ӧ�Ļ�ѧ����ʽΪ________��װ��F��װ�е��Լ�Ϊ_______��
(3)![]() ��
��![]() ���ƣ����Կ���������(CoO)����������(
���ƣ����Կ���������(CoO)����������(![]() )�γɵĻ����д��
)�γɵĻ����д��![]() �����ᷴӦ�Ļ�ѧ����ʽ��__________��
�����ᷴӦ�Ļ�ѧ����ʽ��__________��
(4)�ڶ�С��ͬѧ�������ķ�������һ���������ܷ���ϡ���ᷴӦ�����뼸��ϡ���ᣬ���õ���Һ�����������У���������Ũ����38��40����ȴ�ᾧ�����ȹ��ˣ��õ����塣������ͼ�ܽ�����¶ȱ仯���߽����ܵõ��Ȼ��ܾ����ԭ��____________��
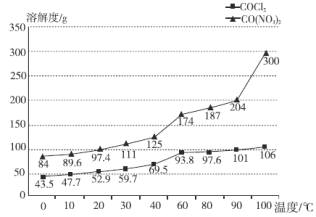
Ϊ��ȷ������Ļ�ѧʽ��С��ͬѧ�Ѿ���ϴ�ӡ���������õ�23.8 g���壬�������������������ٱ仯�����������ʾ����þ���Ļ�ѧʽΪ________��
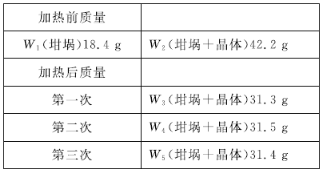
���𰸡�C D E A c��f��g��h��i��f 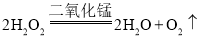
![]() Ũ����
Ũ���� ![]()
![]() Co(NO3)2���ܽ�����¶ȵı仯��
Co(NO3)2���ܽ�����¶ȵı仯��![]() �����Խ������Һ���������ܼ����������
�����Խ������Һ���������ܼ����������![]() ��ˮ�ּ��ٶ�������
��ˮ�ּ��ٶ�������![]() ���ܽ�ȴ���ܽ�����Һ�У����ȹ��˼��ɳ�ȥ
���ܽ�ȴ���ܽ�����Һ�У����ȹ��˼��ɳ�ȥ![]() �õ�������
�õ�������![]() ����
���� ![]()
��������
(1)���ݸ�����ҩƷ����Ӧ��ԭ������װ�õ�ѡ��
(2)����Ҫ�Ʊ���ˮ�����ܣ������������ܵ��Ʊ�װ��ǰ�����װ��Ũ�����ϴ��ƿ���ݴ˽���װ�õ����ӣ�
(3)Co3O4��Fe3O4���ƣ��ݴ˽��з�����
(4) ����![]() ��
��![]() ���ܽ�����¶ȵ�Ӱ�첻ͬ��ѡ�����ʷ����ᴿ�ķ�������þ���Ļ�ѧʽΪ
���ܽ�����¶ȵ�Ӱ�첻ͬ��ѡ�����ʷ����ᴿ�ķ�������þ���Ļ�ѧʽΪ![]() ������ʵ����
������ʵ����![]() ��ƽ�����������n(
��ƽ�����������n(![]() )��n(H2O)��Ȼ������Ȼ�����ˮ����֮�ȵó�����Ļ�ѧʽ��
)��n(H2O)��Ȼ������Ȼ�����ˮ����֮�ȵó�����Ļ�ѧʽ��
(1)���ݸ�����ҩƷ������ѡ��װ�ã�ʵ����ǹ����ĩ��Һ�巴Ӧ��װ��A�������ڹ����ĩ��Һ��ķ�Ӧ��װ��B���ܿ����䷴Ӧ�Ľ�����ֹͣ����װ��C�ʺϣ�ʵ�����Һ����Һ�巴Ӧ��װ��D�ʺϣ�ʵ��� ������ع���ֻ�ܲ��ù������װ�ã�װ��E�ʺϣ�ʵ����ǹ�����Һ�巴Ӧ�������ҷ�Ӧ������ȣ�����ʿ�״��װ��A���ڿ��Ʒ�Ӧ�ķ�����ֹͣ����װ��A�ʺϡ�
(2)����Ҫ�Ʊ���ˮ�����ܣ������������ܵ��Ʊ�װ��ǰ�����װ��Ũ�����ϴ��ƿ���������˳��Ϊc��f��g��h��i��f��
(3)Co3O4��Fe3O4���ƣ���һ��Co3O4�����к���һ��CoO��һ��Co2O3��Co3O4�����ᷴӦ�Ļ�ѧ����ʽΪ![]() ��
��
(4) ![]() ���ܽ�����¶ȵ�Ӱ��仯����
���ܽ�����¶ȵ�Ӱ��仯����![]() ���ܽ�����¶ȵ�Ӱ��仯�ܴ����Խ��˻����Һ���������ܼ����ڽϸ��¶���
���ܽ�����¶ȵ�Ӱ��仯�ܴ����Խ��˻����Һ���������ܼ����ڽϸ��¶���![]() ���ܽ�Ƚϴ�
���ܽ�Ƚϴ�![]() ���ܽ�Ƚ�С�������ܼ�ʱ���������
���ܽ�Ƚ�С�������ܼ�ʱ���������![]() ��ˮ�ּ��ٶ�������Co(NO3)2���ܽ�ȴ���ܽ�����Һ�У����ȹ��˼��ɳ�ȥ
��ˮ�ּ��ٶ�������Co(NO3)2���ܽ�ȴ���ܽ�����Һ�У����ȹ��˼��ɳ�ȥ![]() ���õ�������CoCl2����þ���Ļ�ѧʽΪ
���õ�������CoCl2����þ���Ļ�ѧʽΪ������ʵ����
![]() ��ƽ������Ϊ13.0 g����n(
��ƽ������Ϊ13.0 g����n(![]() )��
)��![]() ��0.1 mol��n(H2O)��
��0.1 mol��n(H2O)��![]() ��0.6 mol��1��a��1��6����˾���Ļ�ѧʽΪ
��0.6 mol��1��a��1��6����˾���Ļ�ѧʽΪ ![]() ��
��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�