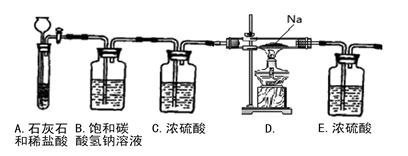
��Ŀ����
������һ����Ҫ���Լ������������ò���̽��Ũ�ȶԷ�Ӧ����Ӱ���ʵ�顣
��1��Ϊ֤��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬���н̿��顶��ѧ��Ӧԭ�������������ʵ�飺ȡ��֧�Թܣ�������4mL0.01mol��L-1��KMnO4������Һ���ֱ������м���0.1 mol��L-1��0.2 mol��L-1 H2C2O4��Һ2mL����¼��Һ��ɫ����ʱ�䡣
ʵ���з�����Ӧ�����ӷ���ʽΪ�� ��
Ԥ�������ǣ�
����Һ����ɫ�� ɫ��Ϊ ɫ��
�����м��� mol��L-1H2C2O4����֧�Թ��е���Һ�ȱ�ɫ��
Ȼ��ʵ���������������⡣ʵ�������ɫ���ӣ�����ɫ�Ȼ��������ӿ죻���������Dz���Ũ�ȴ�Ӧ����ȴ������
��ʵ���ܷ���Ϊ����ʵ���о�Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죿���˵������������ģ�ijУһ�о�С��Դ˽�����̽�������������ǵ�ʵ�鱨���һ���֣�
��1�����鰲�ż����
Ӧ��SPSS16.0���������������з��������������±�
��2��������ˮƽ�����ݴ������
��2���ɱ�2��֪���������У� ��Ũ�ȣ�ѡ�A��B��C�����¿�ͬ���Է�Ӧ����Ӱ���������� ��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�첻������
��3���ɱ�2��֪�����������Ũ��Ϊ mol��L-1������Ũ��Ϊ mol��L-1ʱ����Ӧ��졣������A��B�Ľ�����ʵ����������ȷ����
��������ʵ��������С��ͬѧ����̽�������Ũ��������Ӱ�챾��Ӧ���ʵģ��������ʵ������
��3����ͬ����Ũ���µ���ɫʱ��
��4�����ݿ���ʵ��ĺ���ʱ�䣬��ѡ��Һ����ɫʱ��ԼΪ1���Ӻ�2���ӵ�������Һ������ʱ�����Ũ��Ϊ mol��L-1�� mol��L-1����Ҳ�����ڹ۲���������Ӧ���ʵIJ��졣
���ۣ����������Ը��������Һ�ķ�Ӧ������Ϊ����ʵ��̽��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�졣
��1��Ϊ֤��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬���н̿��顶��ѧ��Ӧԭ�������������ʵ�飺ȡ��֧�Թܣ�������4mL0.01mol��L-1��KMnO4������Һ���ֱ������м���0.1 mol��L-1��0.2 mol��L-1 H2C2O4��Һ2mL����¼��Һ��ɫ����ʱ�䡣
ʵ���з�����Ӧ�����ӷ���ʽΪ�� ��
Ԥ�������ǣ�
����Һ����ɫ�� ɫ��Ϊ ɫ��
�����м��� mol��L-1H2C2O4����֧�Թ��е���Һ�ȱ�ɫ��
Ȼ��ʵ���������������⡣ʵ�������ɫ���ӣ�����ɫ�Ȼ��������ӿ죻���������Dz���Ũ�ȴ�Ӧ����ȴ������
��ʵ���ܷ���Ϊ����ʵ���о�Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죿���˵������������ģ�ijУһ�о�С��Դ˽�����̽�������������ǵ�ʵ�鱨���һ���֣�
��1�����鰲�ż����
| ʵ�� ��� | A��KMnO4��ҺŨ��/mol��L-1�� | B��������ҺŨ��/mol��L-1�� | C��������ҺŨ��/mol��L-1�� | ��ɫʱ��/s |
| 1 | 3 | 3 | 1 | 336 |
| 2 | 1 | 2 | 3 | 82 |
| 3 | 3 | 1 | 3 | 76 |
| 4 | 1 | 3 | 2 | 133 |
| 5 | 2 | 3 | 3 | 102 |
| 6 | 3 | 2 | 2 | 156 |
| 7 | 2 | 2 | 1 | 300 |
| 8 | 2 | 1 | 2 | 115 |
| 9 | 1 | 1 | 1 | 200 |
Ӧ��SPSS16.0���������������з��������������±�
��2��������ˮƽ�����ݴ������
| | A��KMnO4��Һ�� | B��������Һ�� | C��������Һ�� | ||||||
| Ũ��/mol��L-1 | 0.005 | 0.010 | 0.015 | 0.1 | 0.5 | 0.9 | 6 | 12 | 18 |
| ƽ����ɫʱ��/s | 138.3 | 172.3 | 189.3 | 130.3 | 179.3 | 190.3 | 278.7 | 134.7 | 86.7 |
��2���ɱ�2��֪���������У� ��Ũ�ȣ�ѡ�A��B��C�����¿�ͬ���Է�Ӧ����Ӱ���������� ��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�첻������
��3���ɱ�2��֪�����������Ũ��Ϊ mol��L-1������Ũ��Ϊ mol��L-1ʱ����Ӧ��졣������A��B�Ľ�����ʵ����������ȷ����
��������ʵ��������С��ͬѧ����̽�������Ũ��������Ӱ�챾��Ӧ���ʵģ��������ʵ������
��3����ͬ����Ũ���µ���ɫʱ��
| c(H2SO4)/mol��L-1 | 18 | 16 | 14 | 12 | 10 | 8 | 6 |
| ��ɫʱ��/s | 67 | 83 | 90 | 103 | 129 | 146 | 200 |
��4�����ݿ���ʵ��ĺ���ʱ�䣬��ѡ��Һ����ɫʱ��ԼΪ1���Ӻ�2���ӵ�������Һ������ʱ�����Ũ��Ϊ mol��L-1�� mol��L-1����Ҳ�����ڹ۲���������Ӧ���ʵIJ��졣
���ۣ����������Ը��������Һ�ķ�Ӧ������Ϊ����ʵ��̽��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�졣
��14�֣�
��1��2MnO4����5H2C2O4��6H����2Mn2����10CO2����8H2O��3�֣�
��ɫ�����Ϻ�ɫ����1�֣����ޣ�1�֣���0.2��2�֣�
��2��C�����ᣩ A��������أ���B�����ᣩ����1�֣���3�֣�
��3��0.005 �� 0.1����1�֣���2�֣���
��4��18��10����1�֣���2�֣�
��1��2MnO4����5H2C2O4��6H����2Mn2����10CO2����8H2O��3�֣�
��ɫ�����Ϻ�ɫ����1�֣����ޣ�1�֣���0.2��2�֣�
��2��C�����ᣩ A��������أ���B�����ᣩ����1�֣���3�֣�
��3��0.005 �� 0.1����1�֣���2�֣���
��4��18��10����1�֣���2�֣�
���������
��1��������ؾ��������ԡ�������л�ԭ�ԣ�MnO4-��H2C2O4����ΪCO2���壬��������ԭΪMn2+�����ݵ�ʧ������ȡ�����غ㡢�����غ���ƽ��MnO4-����ɫ����Ӧ����ҺΪ��ɫ������Ӧ��Ũ�ȣ���Ӧ���ʼӿ졣
��2���ɱ�2��֪������Ũ�ȶԷ�Ӧ����Ӱ����������������غͲ���Ũ�ȶԷ�Ӧ����Ӱ�첻���ԡ�
��3�������������ҺŨ��Ϊ0.005 mol��L-1��������ҺŨ��Ϊ0.01 mol��L-1ʱ��Ӧ������졣
��4����ɫʱ��1���Ӻ�2���Ӽ�60s��120s����Ӧ��Ũ�ȷֱ�Ϊ18 mol��L-1��10 mol��L-1��

��ϰ��ϵ�д�
 ���������������Բ��������ϵ�д�
���������������Բ��������ϵ�д�
�����Ŀ

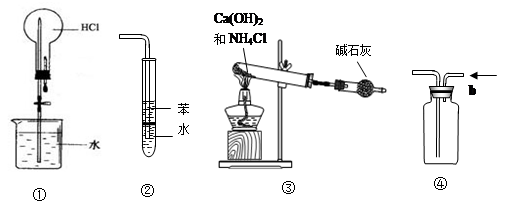
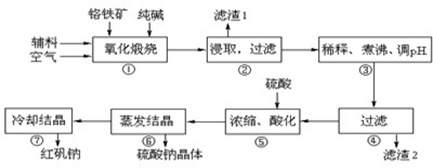
 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2