题目内容
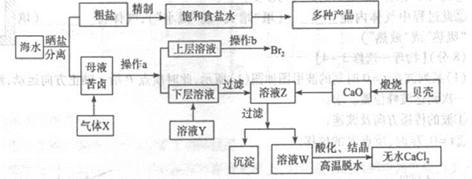
重铬酸钠(Na2Cr2O7?2H2O)俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿(主要成份为FeO?Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:

中涉及的主要反应有:
主反应:4FeO?Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应: SiO2+Na2CO3 Na2SiO3+CO2↑ Al2O3+Na2CO3
Na2SiO3+CO2↑ Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
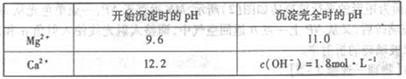
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
试回答下列问题:
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ;
(2)“③”中调节pH至4.7,目的是 ;
(3)“⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式: ;
(4)称取重铬酸钠试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol?L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol?L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断达到滴定终点的依据是: 。
②若实验中共用去Na2S2O3标准溶液40.00ml,所得产品的中重铬酸钠的纯度 (设整个过程中其它杂质不参与反应) 。

中涉及的主要反应有:
主反应:4FeO?Cr2O3+8Na2CO3+7O2
 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2副反应: SiO2+Na2CO3
 Na2SiO3+CO2↑ Al2O3+Na2CO3
Na2SiO3+CO2↑ Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
| 完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
试回答下列问题:
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ;
(2)“③”中调节pH至4.7,目的是 ;
(3)“⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式: ;
(4)称取重铬酸钠试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol?L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol?L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断达到滴定终点的依据是: 。
②若实验中共用去Na2S2O3标准溶液40.00ml,所得产品的中重铬酸钠的纯度 (设整个过程中其它杂质不参与反应) 。
(1)使反应物接触更充分,加快反应速率;
(2)除去溶液中的AlO2-、SiO32-
(3)2CrO42-+2H+ Cr2O72-+H2O
Cr2O72-+H2O
(4)①当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色 ②83.84%
(2)除去溶液中的AlO2-、SiO32-
(3)2CrO42-+2H+
 Cr2O72-+H2O
Cr2O72-+H2O (4)①当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色 ②83.84%
试题分析: (1)反应①反应时不断搅拌目的是加快反应速率。
(2)氧化煅烧后过滤,滤液中阴离子主要含有CrO42-、AlO2-、SiO32-,由表格中信息可知,调节pH至4.7目的是除去溶液中AlO2-、SiO32-。
(3)CrO42-与H+生成Cr2O72-和水。
(4)发生的反应为Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62-,Cr2O72-~3I2~6S2O32-,所以Na2Cr2O7纯度为=
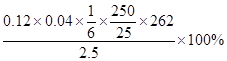 =83.84%。淀粉遇碘显蓝色,加入硫代硫酸钠溶液将碘反应完全后溶液呈无色,所以当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色变为无色且30s不变色为终点。
=83.84%。淀粉遇碘显蓝色,加入硫代硫酸钠溶液将碘反应完全后溶液呈无色,所以当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色变为无色且30s不变色为终点。
练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目