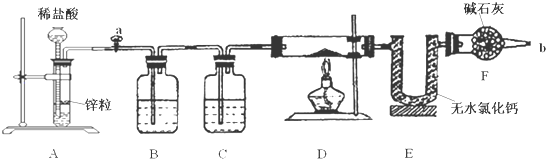
题目内容
9.下列说法中正确的是(NA表示阿伏伽德罗常数)( )①36g D2O含有的质子数为18NA
②16g O2和O3混合物中含氧原子数为NA
③6.4g Cu与过量浓硫酸反应,可得到2.24L SO2
④在标准状况下,22.4L CO2和SO2混合气体中含有原子数为3NA
⑤10L PH=12的NaClO溶液含Na+0.1NA
⑥在标准状况下,22.4L Cl2溶解于足量的水中,转移电子数为NA.
| A. | ①②⑥ | B. | ①③⑤ | C. | ①②④ | D. | ③⑤ |
分析 ①D2O的摩尔质量为20g/mol;
②O2和O3均由氧原子构成;
③SO2的状态不明确;
④求出混合气体的物质的量,然后根据CO2和SO2均含3个原子来分析;
⑤10L PH=12的NaClO溶液中c(H+)=10-12mol/L;
⑥Cl2溶解于的反应为可逆反应,不能进行彻底.
解答 解:①D2O的摩尔质量为20g/mol,故36g重水的物质的量n=$\frac{36g}{20g/mol}$=1.8mol,而1mol重水中含10mol质子,故1.8mol重水中含18mol质子即18NA个,故①正确;
②O2和O3均由氧原子构成,故16g混合物中含有的氧原子的物质的量n=$\frac{16g}{16g/mol}$=1mol,即为NA个,故②正确;
③6.4g Cu即0.1mol铜,与过量浓硫酸反应,可得到SO2的物质的量为0.1mol,但由于二氧化硫的状态不明确,不一定是标况,故体积不一定是2.24L,故③错误;
④标况下,22.4L混合气体的物质的量为1mol,而CO2和SO2均含3个原子,故1mol混合气体中含3mol原子即3NA个,故④正确;
⑤10L PH=12的NaClO溶液中c(H+)=10-12mol/L,c(OH-)=10-2mol/L,根据溶液的电荷守恒可知:n(H+)+n(Na+)=n(OH-)+n(ClO-),而溶液中n(OH-)=10-2mol/L×10L=0.1mol,由于盐的水解程度很小,故未水解的ClO-的物质的量远大于水解生成的OH-的物质的量,即n(ClO-)>0.1mol,则可知n(Na+)=n(OH-)+n(ClO-)-n(H+)>0.2mol,即大于0.2NA个,故⑤错误;
⑥Cl2溶解于的反应为可逆反应,不能进行彻底,故标况下22.4L氯气溶于水后转移的电子数小于NA个,故⑥错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案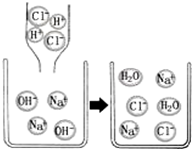
| A. | 反应前后所有元素种类不变 | |
| B. | 恰好反应后溶液的pH大于7 | |
| C. | 反应前的溶液可导电,反应后的溶液不导电 | |
| D. | 中和反应的实质是Na+和Cl-反应生成NaCl |
①生铁、氯水都属于混合物
②AlCl3溶液、蛋白质溶液都属于溶液
③SiO2、CO都属于酸性氧化物
④含氢原子的盐不一定属于酸式盐.
上述说法中正确的是( )
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
| A. | 2mol水的摩尔质量和1mol水的摩尔质量 | |
| B. | 200mL1mol/L氯化钙溶液中c(Cl-)和100mL2mol/L氯化钾溶液中c(Cl-) | |
| C. | 64g二氧化硫中氧原子数和标准状况下22.4L一氧化碳中氧原子数 | |
| D. | 20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度 |
| A. | 1 mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| B. | 等物质的量的N2和CO所含原子数相同,质量相同 | |
| C. | 在标况下,22.4 L SO3所含氧原子为3NA | |
| D. | 1L 0.1 mol•L-1的乙酸溶液中H+数为0.1 NA |
| A. | NaHCO3溶液加水稀释,$\frac{c(N{a}^{+})}{c(HC{{O}_{3}}^{-})}$的比值保持增大 | |
| B. | 在0.1 mol•L一1氨水中滴加0.lmol•L一1盐酸,恰好完全中和时溶液的pH<7 | |
| C. | 向0.lmol/L Na2S03溶液中加人少量NaOH固体,c(Na+)、c(SO32-)均增大 | |
| D. | 0.lmol•L一1氨水加水稀释,溶液中c(H+)和c(OH-)都减小 |