题目内容
17.氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业.CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化.以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
回答下列问题:
(1)步骤①中得到的氧化产物是CuSO4或Cu2+,溶解温度应控制在60~70℃,原因是温度低溶解速度慢、温度过高铵盐分解.
(2)写出步骤③中主要反应的离子方程式2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+.若向亚硫酸氢铵溶液中加入过量氢氧化钠溶液,反应的离子方程式为NH4++HSO3-+2OH-═NH3•H2O+SO32-+H2O
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是硫酸(写名称).
(4)上述工艺中,步骤⑥不能省略,理由是醇洗有利加快去除CuCl表面水分,防止其水解氧化.
(5)准确称取所制备的氯化亚铜样品mg,将其置于过量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用amol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液bmL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为$\frac{0.597ab}{m}$×100%.
分析 酸性条件下硝酸根离子具有氧化性,可氧化海绵铜(主要成分是Cu和少量CuO)生成硫酸铜,过滤后在滤液中加入亚硫酸铵发生氧化还原反应生成CuCl,发生2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,得到的CuCl经硫酸酸洗,水洗后再用乙醇洗涤,可快速除去固体表面的水分,防止水解、氧化,步骤②、④、⑤、⑧都要进行固液分离,根据混合的水溶性进行分离,没有发生化学变化,可用离心机以及框式压滤机,以得到滤饼,氯化亚铜与氯化铁发生Fe3++CuCl═Fe2++Cu2++Cl-,加入K2Cr2O7溶液,发生6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,结合关系式解答该题.
解答 解:酸性条件下硝酸根离子具有氧化性,可氧化海绵铜(主要成分是Cu和少量CuO)生成硫酸铜,过滤后在滤液中加入亚硫酸铵发生氧化还原反应生成CuCl,发生2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,得到的CuCl经硫酸酸洗,水洗后再用乙醇洗涤,烘干得到氯化亚铜.
(1)由于酸性条件下硝酸根离子具有氧化性,可氧化Cu生成CuSO4或Cu2+,溶解温度应控制在60-70℃,原因是温度低溶解速度慢,温度过高铵盐分解,
故答案为:CuSO4或Cu2+;温度低溶解速度慢,温度过高铵盐分解;
(2)铜离子与亚硫酸铵发生氧化还原反应生成CuCl,发生2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+;亚硫酸氢铵溶液中加入过量氢氧化钠溶液反应生成一水合氨和亚硫酸根:NH4++HSO3-+2OH-═NH3•H2O+SO32-+H2O,故答案为:2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+;NH4++HSO3-+2OH-═NH3•H2O+SO32-+H2O;
(3)由流程可知,经酸洗、水洗后得到硫酸铵,则应加入硫酸,为防止CuCl溶解,不能加入硝酸等氧化性酸,也不能加入盐酸,防止引入新杂质,
故答案为:硫酸;
(4)步骤⑥为醇洗,因乙醇沸点低,易挥发,则用乙醇洗涤,可快速除去固体表面的水分,防止水解、氧化,
故答案为:醇洗有利于加快去除CuCl表面水分防止其水解氧化;
(5)氯化亚铜与氯化铁发生Fe3++CuCl═Fe2++Cu2++Cl-,加入K2Cr2O7溶液,发生6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,
反应的关系式为6CuCl~6Fe2+~Cr2O72-,
6 1
n ab×10-3mol
n=6ab×10-3mol,
m(CuCl)=99.5g/mol×6ab×10-3mol=0.597abg,
则样品中CuCl的质量分数为$\frac{0.597ab}{m}$×100%,
故答案为:$\frac{0.597ab}{m}$×100%.
点评 本题考查学生阅读获取信息的能力、常用化学用语、氧化还原滴定的应用等,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握物质的性质以及反应流程,难度中等,注意(5)中利用关系式的计算.

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案| A. | 还原剂只有锂 | |
| B. | 标准状况下生成1.12LSO2时,反应转移电子为0.1mol | |
| C. | 氧化产物包括LiCl和SO2 | |
| D. | SOCl2中既有离子键,也有共价键 |
A是实验室制取CO2的装置,D中装有过氧化钠固体.
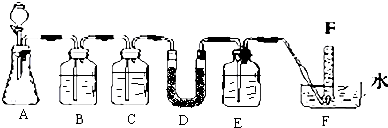
(1)写出A装置中发生反应的离子方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | 除去CO2中的水蒸气 | |
| E |
(4)试管F中收集满气体并从水中取出后,下一步实验操作为:立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气.
(5)写出D中发生反应的化学方程式,并用双线桥标注出电子转移情况
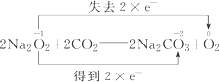 .
. 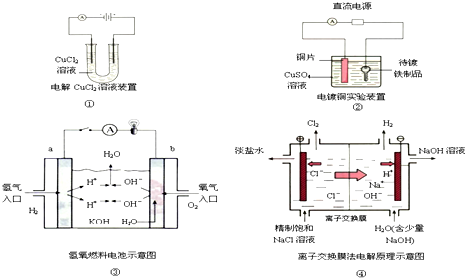
| A. | 装置①中阴极反应式为:2Cl--2e-═Cl2↑,阳极反应式为:Cu2++2e-═Cu | |
| B. | 装置②中铜片为阳极,若开始时铜片和铁制品的质量相等,电解一段时间后,电路中有2 mol电子转移,此时铜片和铁制品的质量差为128 g | |
| C. | 装置③中b极为负极,该极的电极反应方程式为O2+2H2O+4e-═4OH- | |
| D. | 装置④中阳离子交换膜上每透过1mol Na+时,则阴极上产生11.2L H2 |
| A. | 盐酸、水煤气、醋酸、干冰 | B. | 冰醋酸、福尔马林、硫酸钠、乙醇 | ||
| C. | 水玻璃、食盐水、苛性钠、二氧化碳 | D. | 胆矾、漂白粉、氯化钾、氯气 |
| A. | 上述反应中硫元素只被氧化 | |
| B. | Na2S2O3在强酸性环境中能稳定存在 | |
| C. | 每生成1 molNa2S2O3,转移电子数为4NA | |
| D. | 若将Na2CO3换成Na2SO3(配比不变),每吸收3 molSO2,理论上就会生成474 g Na2S2O3 |
 与
与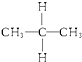 ⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);
⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3); 和
和 ;⑧
;⑧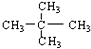 和
和 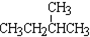 ;
;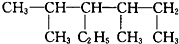 2,4-二甲基-3-乙基己烷
2,4-二甲基-3-乙基己烷 .该高分子材料是由两种单体通过缩聚反应制备而成,其单体的结构简式为
.该高分子材料是由两种单体通过缩聚反应制备而成,其单体的结构简式为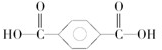 和
和 .
.