题目内容
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)===CO2(g) ΔH1
C(s)+![]() O2(g)===CO(g) ΔH2
O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g) ΔH3
S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+![]() O2(g)===H2O(l) ΔH5
O2(g)===H2O(l) ΔH5
2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7
CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8
A.①② B.①④ C.②③④ D.①②③
【答案】C
【解析】在比较ΔH的大小时要考虑其符号。在①中前者是完全燃烧,而后者是不完全燃烧,放出的热量是前者多,放热时ΔH为负值,故后者大。在②中前者是固态硫燃烧,后者是气态硫燃烧,气态硫所含有的能量高,所以放出的热量是后者多,放热时ΔH为负值,故前者大。在③中前者是1 mol H2燃烧,后者是2 mol H2燃烧,所放出的热量是后者的多,则ΔH是前者大于后者。在④中前者是一个吸热反应ΔH7>0,而后者是一个放热反应,ΔH8<0,故ΔH7>ΔH8。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案【题目】某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体_____g。
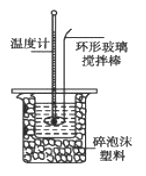
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
(1)写出该反应的热化学方程式(中和热为57.3 kJ/mol):_____________。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ______ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | ||
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H=______________取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是:______。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向盛有1mL浓硫酸的试管中加入5mL0.1mol/L的K2Cr2O7溶液 | 溶液橙色变深 | 增大生成物浓度,平衡Cr2O72-(橙色)+ H20 |
B | 向Mg(OH)2悬浊液中加入少量氯化铵晶体 | 沉淀溶解,溶液变澄清 | 说明反应Mg(OH)2+2NH4+ |
C | 白铁皮(镀锌铁)出现刮痕后浸泡在饱和食盐水中,一段时间后滴入几滴K3[Fe(CN)6]溶液 | 无明显现象 | 该过程未发生原电池反应 |
D | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰,煤炭燃烧更旺 | 加少里水后,可使煤炭燃烧放出更多的热量 |
A. A B. B C. C D. D
