题目内容
【题目】下列说法正确的是
A. 由C(石墨) = C(金刚石) △H=+1.9 kJ·mol-1可知,金刚石比石墨稳定
B. 在一定条件下,等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
C. 已知2C(s) + O2(g) = 2CO(g) △H=-221 kJ·mol-1,可知C的标准燃烧热为110.5 kJ·mol-1
D. 在一密闭容器中,9.6 g的硫粉与11.2 g的铁粉混合加热,充分反应,生成硫化亚铁17.6 g,放出19.12 kJ的热量,则Fe(s) + S(s) = FeS(s) △H= - 95.6 kJ·mol-1
【答案】D
【解析】
A. 物质所具有的能量越低越稳定,因C(石墨) = C(金刚石) △H=+1.9 kJ·mol-1可知,石墨的能量比金刚石的低,则石墨比金刚石稳定,A项错误;
B. 在一定条件下,等物质的量的硫蒸气的能量比硫固体的能量高,则两者分别完全燃烧,前者放出的热量多,B项错误;
C. 燃烧热是在25°C,101 kPa时,1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量,已知2C(s) + O2(g) = 2CO(g) △H=-221 kJ·mol-1,产物CO不是C的稳定氧化物,则不能求出标准燃烧热,C项正确;
D. 密闭容器中,9.6g硫粉物质的量=![]() =0.3mol,与11.2g铁粉物质的量=
=0.3mol,与11.2g铁粉物质的量=![]() = 0.2mol,混合加热生成硫化亚铁17.6g时,硫过量,放出19.12kJ 热量,所以1mol铁反应放热=19.12kJ ×
= 0.2mol,混合加热生成硫化亚铁17.6g时,硫过量,放出19.12kJ 热量,所以1mol铁反应放热=19.12kJ ×![]() =95.6kJ,热化学方程式为Fe(s)+S(s)═FeS(s)△H=-95.6kJ.mol-1,D项正确;
=95.6kJ,热化学方程式为Fe(s)+S(s)═FeS(s)△H=-95.6kJ.mol-1,D项正确;
答案选D。

【题目】某研究小组提取三处被污染的水源进行了如下分析,给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E为五种常见化合物,均由下表中的离子形成:
阳离子 | K+ Na+ Cu2+ Al3+ |
阴离子 | SO42- HCO3- NO3- OH- |
为了鉴别上述化合物,分别完成以下实验,其结果是
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
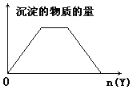
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化学式:B________,D________。
(2)写出D、E发生反应的离子方程式:___________________________。
(3)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为__________。
(3)C常用作净水剂,用离子方程式表示其净水原理:________________。