题目内容
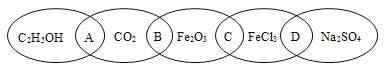
【题目】A、B、C、D、E、F、G是前四周期的七种元素,其原子序数依次增大。A的基态原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D及其同主族元素的氢化物沸点变化趋势如图(D的氢化物沸点最高);F是地壳中含量最高的金属元素;G与F同主族。请回答下列问题:
(1)写出F元素基态原子的核外电子排布式:____________。
(2)B、C、D三种元素电负性由大到小的顺序是____________(用元素符号表示)。
(3)有关上述元素的下列说法,正确的是________(填序号)。
①CA3沸点高于BA4,主要是因为前者相对分子质量较大
②配合物Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于离子晶体
③C的氢化物的中心原子采取sp2杂化
④F单质的熔点高于E单质,是因为F单质的金属键较强
⑤比G的原子序数少1的元素第一电离能高于G
(4)CA3分子的立体构型为________,1 mol B2A4分子中含有________个σ键;
【答案】1s22s22p63s23p1 O>N>C ④⑤ 三角锥形 5NA
【解析】
A、B、C、D、E、F、G是前四周期的七种元素,其原子序数依次增大,
A的基态原子中没有成对电子,则A为氢元素;
B的基态原子中电子占据三种能量不同的原子轨道,每种轨道中的电子总数相同,则B的核外电子排布式为12S22P2,则B为碳元素;
F是地壳中含量最高的金属元素,则F为铝元素;
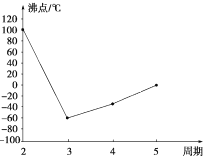
由D及其同主族元素的氢化物沸点变化趋势图可知,D的氢化物的沸点在同主族元素的氢化物中最高,沸点为100℃,所以D为氧元素;
C的原子序数介于碳元素与氧元素之间,则C为氮元素;
G与F同主族,F为铝元素,原子序数大于铝元素,为前四周期元素,则G为Ga元素。
根据上述分析可知:
A为氢元素,B为碳元素,C为氮元素,D为氧元素, F为铝元素,G为Ga元素.
(1)F为铝元素,原子核外电子数为13,基态原子的价电子排布式为1s22s22p63s23p1,
故答案为:1s22s22p63s23p1;
(2)B为碳元素,C为氮元素,D为氧元素,位于同一周期,自左而右电负性逐渐增大,所以B、C、D三种元素电负性由大到小的顺序是O>N>C,
故答案为:O>N>C;
(3)①NH3沸点高于CH4,主要是因为前者分子间能形成氢键,①项错误;
②Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,属于分子晶体的性质,因此固态Ni(BD)4属于分子晶体,②项错误;
③C的氢化物,即NH3的中心原子采取sp3杂化,③项错误;
④金属元素的原子半径越小、价电子数越多,则金属键越强,金属的熔点越高,所以Al单质的熔点高于Mg单质,④项正确;
⑤同周期中第IIA族元素的电离能比第IIIA族元素的电离能高,所以比G的原子序数少1的元素第一电离能高于G,⑤项正确;
故答案为:④⑤;
(4)NH3分子中σ键电子对为3,孤电子对为1,即价层电子对数为4,所以NH3的空间构型为:三角锥形;1mol C2H4分子中含有 4molC-H和1molC=C,所以1mol C2H4分子中含有5NA个 σ键,
故答案为:三角锥形;5NA。

【题目】大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)之后才能排放。
(1)CO和H2可作为能源和化工原料,应用十分广泛。 反应CO(g)+H2O(g) ![]() H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
①从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
②在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为________。
(2)在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ·mol1
2CO2(g) ΔH=566.0 kJ·mol1
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+180.0 kJ·mol1
2NO(g) ΔH=+180.0 kJ·mol1
③2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 kJ·mol1
2NO2(g) ΔH=116.5 kJ·mol1
回答下列问题:
①CO的燃烧热为 _________。若1 mol N2(g)、1 mol O2(g) 分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1 mol NO(g) 分子中化学键断裂时需吸收的能量为_________kJ。
②写出CO将NO2还原为单质反应的热化学方程式为 ____________________
(3)汽车排气管上的催化转化器,发生上述的CO将NO2还原为单质反应。在一定温度下,将一定量的CO和NO2充入2L固定容积的容器中,回答以下问题:
①能说明该反应达到平衡状态的是_____________(填字母标号)。
A.2υ正(NO2)=υ逆(N2)
B. 混合气体的平均相对分子质量保持不变
C.气体总压强不再变化
D. ΔH保持不变
E.混合气体的密度不再变化
②从反应开始到5min,生成了0.08mol N2,则5min内υ(CO)=___molL1min1。
③25min时,物质浓度变化如图所示,则改变的条件可能是___________(填字母标号)。
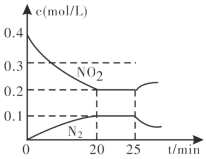
A.缩小容器体积
B.增加NO2的浓度
C.降低温度
D.升高温度