题目内容
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应△H1、△H2、△H3的关系正确的是
| A.△H1>△H2>△H3 | B.△H1<△H3<△H2 |
| C.△H1<△H2<△H3 | D.△H1>△H3>△H2 |
D
解析试题分析:醋酸为弱酸,其电离过程需要吸热所以放出的热量小于57.3kJ,浓硫酸遇水放热,放出的能量大于57.3kJ ;比较焓变大小需要加上负号,确定D对。
考点:中和热。

已知下列热化学方程式:
Zn(s) + 1/2 O2(g)= ZnO(s) ΔH= -351.1 kJ·mol-1 ①
Hg(l) + 1/2 O2(g)= HgO(s) ΔH= -90.7 kJ·mol-1 ②
由此可知Zn(s)+ HgO(s)= ZnO(s)+ Hg(l)的反应热ΔH为
| A.-260.4 kJ·mol-1 | B.+260.4 kJ·mol-1 | C.- 441.8 kJ·mol-1 | D.+ 441.8 kJ·mol-1 |
已知:H+(aq) + OH—(aq)=H2O(l) △H=—57.3kJ/mol。向1L 0.5mol/L的NaOH溶液中加入下列物质:①稀盐酸;②浓H2SO4;③稀醋酸,恰好完全反应的热效应△H1、△H2、△H3的关系正确的是
| A.△H1>△H2>△H3 | B.△H3>△H1>△H2 |
| C.△H1=△H3>△H2 | D.△H2>△H1>△H3 |
下列热化学方程式正确的是(注: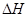 的绝对值均正确)( )
的绝对值均正确)( )
| A.C2H5OH(l)+3O2(g)=2CO2(g) +3H2O(g);△H=" —1367.0" kJ/mol(燃烧热) |
| B.NaOH(aq) + HCl(aq)="NaCl(aq)" + H2O(l);△H= —57.3kJ/mol(中和热) |
| C.S(s) + O2(g) = SO2(g);△H= —269.8kJ/mol(反应热) |
| D.2HCl(g)=Cl2(g) + H2(g);△H=" —" 184.6kJ/mol(反应热) |
S(单斜)和S(正交)是硫的两种同素异形体。
已知:①S(单斜,s)+O2(g)=SO2(g) ΔH1=-297.16 kJ·mol-1
②S(正交,s)+O2(g)=SO2(g) ΔH2=-296.83 kJ·mol-1
③S(单斜,s)=S(正交,s) ΔH3
下列说法正确的是( )
| A.ΔH3=+0.33 kJ·mol-1 |
| B.单斜硫转化为正交硫的反应是吸热反应 |
| C.S(单斜,s)=S(正交,s) ΔH3<0,正交硫比单斜硫稳定 |
| D.S(单斜,s)=S(正交,s) ΔH3>0,单斜硫比正交硫稳定 |
下列变化过程,属于放热反应的是( )
①液态水变成水蒸气 ②酸碱中和反应 ③浓H2SO4稀释
④固体NaOH溶于水 ⑤H2在Cl2中燃烧 ⑥弱酸电离
| A.②③④⑤ | B.②③④ | C.②⑤ | D.①③⑤ |
下列反应属于吸热反应的是 ( )
| A.中和反应 | B.锌与稀硫酸反应 |
| C.炭燃烧生成CO | D.炭与高温水蒸汽反应 |
下列关于能量转换的认识中不正确的是
| A.原电池工作时化学能全部转化为电能 |
| B.工业上电解氧化铝制备铝,电能转化成化学能 |
| C.镁在空气中燃烧时化学能不只转变成热能 |
| D.绿色植物光合作用过程中太阳能转变成化学能 |