题目内容
某些化学知识用数轴表示能体现出形象直观、简明易记的特点,下列用数轴表示不合理的是
A. 平衡常数与转化率关系: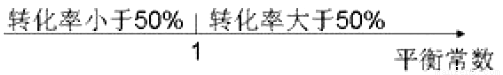
B. 向烧碱液中通入SO2后的产物:
C. 铁和稀硝酸反应: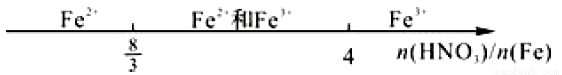
D. 向AlCl3溶液中滴加NaOH溶液,铝元素的存在形式:
练习册系列答案
相关题目
下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 浓硫酸与乙醇170℃共热,制得的气体通入酸性KMnO4溶液 | 溶液紫色褪去 | 制得的气体为乙烯 |
B | 测定等浓度的Na2CO3和Na2SO3的溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
C | 向2.0ml浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1AgNO3溶液,振荡 | 沉淀呈黄色 | Ksp(AgCl)>Ksp(AgI) |
D | 向待测液中先滴加Ba(NO3)2溶液, 再滴加稀盐酸 | 出现白色沉淀 | 原待测液中一定含有SO42- |
A. A B. B C. C D. D


 O2(g) = CO2(g)+2H2O(1) △H1=akJ•mol-1
O2(g) = CO2(g)+2H2O(1) △H1=akJ•mol-1 O2(g) = H2O(1) △H2=bkJ•mol-1
O2(g) = H2O(1) △H2=bkJ•mol-1 CH3OH(g)+H2O(g) △H=__________kJ•mol-1
CH3OH(g)+H2O(g) △H=__________kJ•mol-1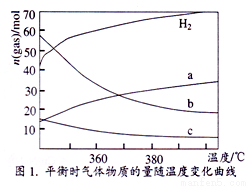
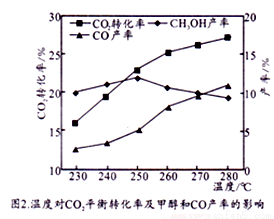
 6FeO+O2↑ ,每分解1mol Fe3O4转移电子的物质的量为_____________;“重整系统”发生反应的化学方程式为_____________________________________________。
6FeO+O2↑ ,每分解1mol Fe3O4转移电子的物质的量为_____________;“重整系统”发生反应的化学方程式为_____________________________________________。
 3C (g) 。下列叙述中表明该可逆反应一定达到平衡状态的是
3C (g) 。下列叙述中表明该可逆反应一定达到平衡状态的是