题目内容
1. 某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验.请回答:
某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验.请回答:(1)试管Ⅰ中发生反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)下列实验不合理的是D.
A.上下移动Ⅰ中铜丝可控制生成SO2的量
B.Ⅱ中选用品红溶液验证SO2的生成
C.Ⅲ中可选用NaOH溶液吸收多余的SO2
D.为确认CuSO4生成,向Ⅰ加水,观察溶液颜色
(3)实验中,用ag铜片和VmL18.4mol•L-1的浓硫酸(98%)放在试管中共热,直到反应完毕,发现试管中还有铜片剩余,该小组学生认为还有一定量的硫酸剩余.
①有一定量的硫酸剩余但未能使铜片完全溶解,你认为原因是反应中浓硫酸被消耗,同时生成水,浓硫酸逐渐变稀,而Cu不能与稀硫酸反应
②下列药品中能用来证明反应结束后的试管中确有硫酸剩余的是ad(填序号).
a.铁粉 b.BaCl2溶液 c.Ba(NO3)2溶液 d.Na2CO3溶液.
分析 (1)试管Ⅰ中铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水;
(2)A.通过抽动铜丝可以控制Cu与浓硫酸的接触面积;
B.二氧化硫可以使品红溶液褪色;
C.二氧化硫能与氢氧化钠溶液反应;
D.应将试管中的溶液倒入水中,防止硫酸溅出伤人;
(3)①随反应进行,浓硫酸变稀,Cu不能与稀硫酸反应;
②硫酸、硫酸铜均匀钡盐反应得到硫酸钡沉淀,剩余的硫酸能与Fe、碳酸钠反应生成气体,据此检验是否有硫酸剩余.
解答 解:(1)试管Ⅰ中铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水,反应方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)A.通过抽动铜丝可以控制Cu与浓硫酸的接触面积,可以控制生成SO2的量,故A不选;
B.二氧化硫可以使品红溶液褪色,根据品红溶液是否褪色判断是否有二氧化硫生成,故B不选;
C.未反应二氧化硫直接排放,会污染气体,二氧化硫能与氢氧化钠溶液反应,可选用NaOH溶液吸收多余的SO2
,故C不选;
D.应将试管中的溶液倒入水中,防止硫酸溅出伤人,故选D选,
故选:D;
(3)①反应中浓硫酸被消耗,同时生成水,浓硫酸逐渐变稀,而Cu不能与稀硫酸反应,故有一定量的硫酸剩余,
故答案为:反应中浓硫酸被消耗,同时生成水,浓硫酸逐渐变稀,而Cu不能与稀硫酸反应;
②氯化钡、硝酸钡均与硫酸、硫酸铜反应反应得到硫酸钡沉淀,不能用检验硫酸是否有剩余,剩余的硫酸能与Fe、碳酸钠反应生成气体,据此可以检验硫酸是否有剩余,
故选ad.
点评 本题考查浓硫酸性质探究实验,是对学生综合能力的考查,有利于培养学生的化学实验能力、分析解决问题的能力.

| 序号 | 反应① | 反应② |
| A | NaOH与HCl反应 | Mg(OH)2与HNO3反应 |
| B | 向BaCl2溶液中滴加稀H2SO4 | 向Ba(OH)2溶液中滴加CuSO4溶液 |
| C | Cl2通入NaOH溶液中 | Cl2通入澄清石灰水中 |
| D | Fe与HCl反应 | Fe与CH3COOH反应 |
| A. | A | B. | B | C. | C | D. | D |
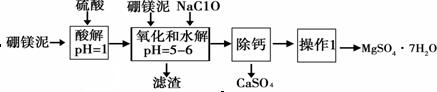
根据题意回答下列问题:
(1)实验中需用1mol•L-1的硫酸80mL,若用98%的浓硫酸配制,除量筒、玻璃棒外,还需要的玻璃仪器有烧杯、100mL的容量瓶、胶头滴管.
(2)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式:Mn2++ClO-+H2O=MnO2↓+2H++Cl-.
(3)在调节pH=5~6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+.
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(6)如果提供的硼镁泥共100g,得到的MgSO4•7H2O 196.8g,则MgSO4•7H2O的产率为80%.
| A. | HX | B. | H2X | C. | XH3 | D. | XH5 |
| A. | K+、CO32-、HS-、S2-、Al3+、AlO2- | B. | MnO4-、Na+、SO42-、K+、Cl- | ||
| C. | SO42-、Ag+、SO32-、S2-、AlO2-、K+ | D. | Fe3+、Cl-、H+、NO3- |
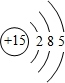 ;
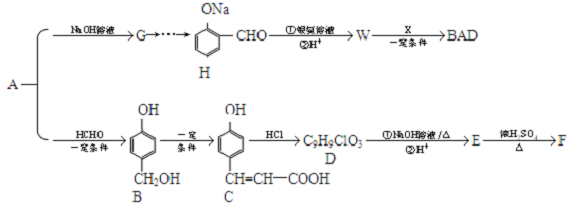
;
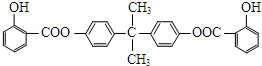
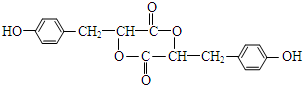
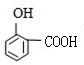 .
. .
. .
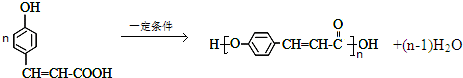
.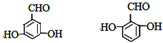 (其中一种).
(其中一种). .
. ,Y的结构式为
,Y的结构式为 .
.