题目内容
【题目】高铁酸钾(K2FeO4)是一种高效净水剂.已知:K2FeO4 易溶于水,其溶液呈紫色、微溶于浓KOH 溶液,在0℃~5℃的强碱性溶液中较稳定.某小组同学用下图装置制备并探究
K2FeO4 的性质.制备原理:
3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,装置如图所示(夹持装置略)
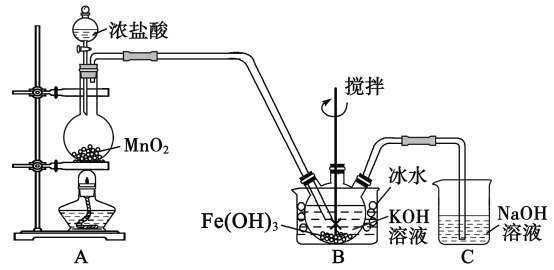
(1)盛放二氧化锰的仪器名称___________________,装置C的作用是____________________。
(2)装置A 中反应的化学方程式是________________________________________。
(3)实验时采用冰水浴的原因是____________________,此装置存在一处明显缺陷,请指出____________。
(4)K2FeO4 粗产品含有Fe(OH)3、KCl等杂质,一般用75%乙醇进行洗涤,其目的是_____________________。
(5)查阅资料知,K2FeO4 能将 Mn2+氧化成 MnO4-.该小组设计如下实验进行验证:
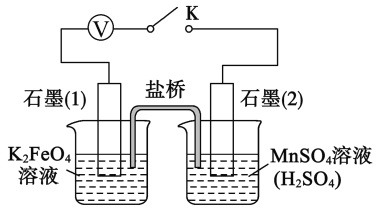
关闭K,左烧杯溶液变黄色,右烧杯溶液变紫色.检验左侧烧杯溶液呈黄色的原因,需要的试剂是__________。写出K2FeO4 氧化Mn2+ 的离子方程式: ___________________.
【答案】圆底烧瓶 吸收多余的氯气,防止污染环境 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O K2FeO4在0℃~5℃环境中稳定,防止副反应发生 缺少除Cl2中混有的HCl的装置 减少产品损失,易于干燥 硫氰酸钾溶液(KSCN溶液) 5FeO42-+3Mn2++16H+====5Fe3++3MnO4-+8H2O
MnCl2+Cl2↑+2H2O K2FeO4在0℃~5℃环境中稳定,防止副反应发生 缺少除Cl2中混有的HCl的装置 减少产品损失,易于干燥 硫氰酸钾溶液(KSCN溶液) 5FeO42-+3Mn2++16H+====5Fe3++3MnO4-+8H2O
【解析】
根据物质的制备、分离和提纯实验原理分析解答;根据离子方程式的书写规则分析解答。
(1)A装置是反应装置生成Cl2,B装置是Cl2制备高铁酸钾,C装置是尾气处理装置,则盛放二氧化锰的仪器是圆底烧瓶,装置C的作用是吸收未反应的Cl2;
故答案为:圆底烧瓶,吸收多余的氯气,防止污染环境;
(2)装置A 是用浓盐酸与MnO2共热制备Cl2,反应的化学方程式为MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(3)从已知条件可知,K2FeO4在0℃~5℃的强碱性溶液中较稳定,所以实验时采用冰水浴的原因是K2FeO4在0℃~5℃环境中稳定,防止副反应发生,此装置存在一处明显缺陷,是缺少除Cl2中混有的HCI的装置;
故答案为:K2FeO4在0℃~5℃环境中稳定,防止副反应发生;缺少除Cl2中混有的HCl的装置;
(4)K2FeO4 粗产品含有Fe(OH)3、KCl等杂质,一般用75%乙醇进行洗涤是由于K2FeO4 易溶于水,不能用水洗涤,使用乙醇洗涤是为了减少产品损失,易于干燥;
故答案为:减少产品损失,易于干燥;
(5)由题意可知,K2FeO4作氧化剂,得到电子,即石墨(1)作阴极,阴极FeO42-得到电子后生成Fe3+,检验Fe3+可以选用KSCN试剂,石墨(2)作阳极,Mn2+失去电子生成MnO4-,离子方程式为:5FeO42-+3Mn2++16H+====5Fe3++3MnO4-+8H2O,
故答案为:硫氰酸钾溶液(KSCN溶液),5FeO42-+3Mn2++16H+====5Fe3++3MnO4-+8H2O。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案