题目内容
【题目】工业上用氢气合成氨气的原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
(1)用太阳能分解水制备H2是一项新技术,其过程如下
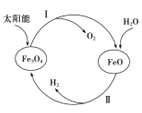
已知:2H2O(g)=2H2(g)+O2(g) ΔH=+483.6kJ·mol-1 2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.8kJ·mol-1
①过程Ⅱ的热化学方程式是____________________________________.
②整个过程中,Fe3O4 的作用是________________________.
(2)在2L密闭容器中通入3molH2和1molN2,测得不同温度下,NH3的产率随时间变化如图所示.

①下列有关说法正确的是_______________________
A 由b点到c点混合气体密度逐渐增大
B 达到平衡时,2v正(H2)=3v逆(NH3)
C 平衡时,通入氩气平衡正向移动
D 平衡常数,ka<kb=kc
②T1 温度时,0-15min内v(H2)=___________ mol·L-1·min-1.
③已知:瞬时速率表达式v正=k正c3(H2)c(N2),v逆=k逆c2(NH3)(k 为速率常数,只与温度有关).温度由T1 调到T2,活化分子百分率 ______________(填“增大”“减小”或“不变”),k正增大倍数______________k逆增大倍数(填“大于”“小于”或“等于”).T1℃时,k正/k逆=__________ 。
【答案】3FeO(s)+H2O(g)====Fe3O4(s)+H2(g) H=+84.9kJ/mol 催化剂 BD 0.05 增大 小于 ![]() 或2.37
或2.37
【解析】
根据化学平衡图象分析解答;根据热化学反应方程式的书写规则分析解答。
①过程Ⅱ是FeO与水、O2反应生成Fe3O4和H2,该反应的的热化学方程式是3FeO(s)+H2O(g)====Fe3O4(s)+H2(g) H=+84.9kJ/mol,
故答案为:3FeO(s)+H2O(g)====Fe3O4(s)+H2(g) H=+84.9kJ/mol;
②整个过程中Fe3O4是作催化剂的作用,
故答案为:催化剂;
(2)①A.由图象可知,b点→c点NH3的物质的量增多,混合气体密度减小,故A错误;
B.达到平衡时,v正(H2)=v逆(H2),即可根据反应方程式推断出,2v正(H2)=3v逆(NH3),故B正确;
C.氩气对平衡没有影响,故C错误;
D.平衡常数只受温度影响,则ka<kb=kc,故D正确;
故答案为:BD;
②T1 温度下,15min时,NH3的产率占50%,反应n(H2)=1.5mol,v(H2)=![]() =0.05mol·L-1·min-1,
=0.05mol·L-1·min-1,
故答案为:0.05mol·L-1·min-1;
③有图象可知,T1时的反应速率比T2时反应速率小,所以温度由T1 调到T2,活化分子百分率增大,k正增大倍数小于k逆增大倍数,T1℃时,NH3的产率是50%,根据方程式可知:
N2 + 3H2![]() 2NH3
2NH3
初始c(mol/L) 0.5 1.5 0
反应了 0.25 0.75 0.5
平衡时 0.25 0.75 0.5 K=![]() =
=![]() ,
,![]() ,计算可知,k正/k逆=
,计算可知,k正/k逆=![]() =2.37,
=2.37,
故答案为:增大;小于;![]() 或2.37。
或2.37。

 名校课堂系列答案
名校课堂系列答案