��Ŀ����
����Ŀ����������Ĵ��ڻ��ƻ�����������һֱ�ڻ���̽�����ƴ�����������Ч��ʩ����֪��N2(g)+O2(g)![]() 2NO(g) ��H=+181.5kJ��mol��1
2NO(g) ��H=+181.5kJ��mol��1
��1�������������γɳ�����ն��⻯ѧ������_______(�о�һ��)�ȴ�����Ⱦ���������֮һ��
��2��ij����С�鳢�����ù����������ս���NO�ķֽ⡣����![]() ��
��![]() ��
��![]() ��
��![]() �ֱ��ʾN2��NO��O2����������ڹ����������ֽ�NO�Ĺ�����ͼ��ʾ���������������Ĺ����У�����״̬��͵���_______(����ĸ���)��
�ֱ��ʾN2��NO��O2����������ڹ����������ֽ�NO�Ĺ�����ͼ��ʾ���������������Ĺ����У�����״̬��͵���_______(����ĸ���)��

��3���¶�ΪT1ʱ�����ݻ�Ϊ1L�ĺ����ܱ������г���0.6molNO2����������Ӧ2NO2(g)![]() 2NO(g)+O2(g) ��H>0����ƽ��ʱc(O2)=0.2mol��L��1������¶��·�Ӧ��ƽ�ⳣ��Ϊ______��ʵ���ã�v��=v(NO2)����=k��c2(NO2)��v��= v (NO2)����=2v(O2)����=k��c2(NO)��c(O2)��k����k��Ϊ���ʳ����������¶�Ӱ�졣���¶ȸı�ΪT2ʱ����k��=k������T1_____T2(����>������<��)��
2NO(g)+O2(g) ��H>0����ƽ��ʱc(O2)=0.2mol��L��1������¶��·�Ӧ��ƽ�ⳣ��Ϊ______��ʵ���ã�v��=v(NO2)����=k��c2(NO2)��v��= v (NO2)����=2v(O2)����=k��c2(NO)��c(O2)��k����k��Ϊ���ʳ����������¶�Ӱ�졣���¶ȸı�ΪT2ʱ����k��=k������T1_____T2(����>������<��)��
��������(NOx)�ǵ糧��Ҫ�ŷŵ���Ⱦ��֮һ����ҵ�ϲ��ð������������ŷţ�ԭ�����£�
��4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) ��H1=��1632.4kJ��mol��1��
4N2(g)+6H2O(g) ��H1=��1632.4kJ��mol��1��
��4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) ��H2=akJ��mol��1��
5N2(g)+6H2O(g) ��H2=akJ��mol��1��
����Ӧ�¶ȹ���ʱ��NH3����������Ӧ��
��4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ��H3=��902.0kJ��mol��1��
4NO(g)+6H2O(g) ��H3=��902.0kJ��mol��1��
��4����Ӧ���е�a=______��
��5����Ӧ���У����õĴ�����Cr2O3��Fe2O3��Cr2O3�Ĵ�Ч�ʸ���һЩ�����б�ʾ���ִ����ڷ�Ӧ�ڴ������е������仯ʾ��ͼ��������______(��ѡ����ĸ)��

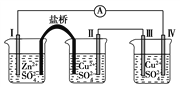
�����õ�ⷨ�������¿�����ϡ����NO(O2Ũ��ԼΪNOŨ�ȵ�10��)��װ��ʾ��ͼ���£��������ʿɴ���O2��
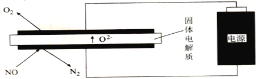
��6�������ĵ缫��ӦʽΪ______��
��7������һ������NO�����ĵĵ���ԶԶ�������ۼ����������ܵ�ԭ����(��������������)______��
��8��ͨ�������缫����Ĵ��������Ը�����һ״�������ô�������______�ԡ�
���𰸡������������꣩ C 0.8 < -1815.0 B 2NO+4e-=N2+2O2- ������������ӦO2+4e-=2O2- ѡ��
��������
��1�������������γɳ�����ն��⻯ѧ����������������ȴ�����Ⱦ���������֮һ��
��2���ƻ���ѧ����Ҫ�����������γɻ�ѧ����Ҫ�ų�����������Խ��Խ���ȶ���Խ��Խ�ȶ���
��3�������¶�ƽ�������ȷ�Ӧ�����ƶ���
��4�����ݸ�˹���ɼ���aֵ��
��5����Ӧ���У�Cr2O3�Ĵ�Ч�ʸ���һЩ������ʹ��Cr2O3��ܸ��ͣ����ݼ��㷴Ӧ�ڵķ�Ӧ������������С�ڷ�Ӧ�
��6������������ԭ��Ӧ��
��7��������������Ӧ��O2+4e-=2O2-��
��8����������ѡ���ԡ�
��1�������������γɳ�����ն��⻯ѧ����������������ȴ�����Ⱦ���������֮һ��
�ʴ�Ϊ�����������ꣻ
��2���ӻ������Կ���������A״̬�У�NO���������������棬B״̬ΪNO��ΪNԭ�Ӻ�Oԭ�ӣ����������Ҫ����������C״̬ΪNԭ�Ӻ�Nԭ�ӽ�ϱ��N2��Oԭ�Ӻ�Oԭ�ӽ�ϱ��O2���������Ϊ�ɼ����̣���Ҫ�ų���������ϵ�������ͣ�
�ʴ�Ϊ��C��
��3����������ݿ�֪���¶�ΪT1ʱ��c(NO2)=(0.6mol/L-0.4mol/L)��c(NO)=0.4mol/L�� c(O2)=0.2mol/L����ѧƽ�ⳣ��K=![]() =0.8��
=0.8��
�ﵽƽ��״̬ʱ���淴Ӧ������ȣ�����k��c2(NO2)=k��c2(NO)��c(O2)����k��=k������֪
c2(NO2)=c2(NO)��c(O2)����ʱK=![]() =1>0.8�����ڸ÷�Ӧ������ӦΪ���ȷ�Ӧ��˵�������¶�ƽ�������ƶ�������T1<T2��
=1>0.8�����ڸ÷�Ӧ������ӦΪ���ȷ�Ӧ��˵�������¶�ƽ�������ƶ�������T1<T2��
�ʴ�Ϊ��0.8 ��<��
��4����֪��4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) ��H1=��1632.4kJ��mol��1��
4N2(g)+6H2O(g) ��H1=��1632.4kJ��mol��1��
��4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ��H3=��902.0kJ��mol��1��
4NO(g)+6H2O(g) ��H3=��902.0kJ��mol��1��
���ݸ�˹���ɣ�[��![]() 5-��]
5-��]![]() 4�â�4NH3(g)+6NO(g)
4�â�4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) ��H2=[(��1632.4kJ��mol��1��
5N2(g)+6H2O(g) ��H2=[(��1632.4kJ��mol��1��![]() 5��(��902.0kJ��mol��1��]
5��(��902.0kJ��mol��1��]![]() 4=akJ��mol��1����a=-1815.0
4=akJ��mol��1����a=-1815.0
�ʴ�Ϊ��-1815.0��
��5����Ӧ���У�Cr2O3�Ĵ�Ч�ʸ���һЩ������ʹ��Cr2O3��ܸ��ͣ����ݼ��㷴Ӧ��Ϊ���ȷ�Ӧ�����������������С�ڷ�Ӧ��ģ�Bͼ�������⣬ѡB��
�ʴ�Ϊ��B��
��6������װ��ʾ��ͼ��֪��������ӦΪ��2NO+4e-=N2+2O2-��
�ʴ�Ϊ��2NO+4e-=N2+2O2-��
��7������һ������һ�����������ĵĵ���ԶԶ�������ۼ�������������������������Ӧ��O2+4e-=2O2-��
�ʴ�Ϊ��������������Ӧ��O2+4e-=2O2-��
��8��ͨ�������缫����Ĵ��������Ը�����һ״�������ô�������ѡ���ԡ�
�ʴ�Ϊ��ѡ��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�