题目内容
对应于下列物质中的中心原子的杂化轨道类型和分子的立体构型有错误的是( )
| A.BeCl2中的Be,sp,直线形 |
| B.SiF4中的Si,sp3,正四面体形 |
| C.BCl3中的B,sp2,平面三角形 |
| D.C6H6中的C,sp,平面正六边形 |
A.BeCl2中价层电子对个数=2+
(2-2×1)=2,且不含孤电子对,所以空间构型是直线形,且中心原子是以sp杂化,故A正确;
B.SiH4中价层电子对个数=4+
(4-4×1)=4,且不含孤电子对,所以空间构型是正四面体形结构,中心原子是以sp3杂化,故B正确;
C.BCl3中价层电子对个数=3+
(3-3×1)=3,且不含孤电子对,所以空间构型是平面三角形,中心原子是以sp2杂化,故C正确;
D.C6H6中的C含有3个σ 键且不含孤电子对,所以碳原子采用sp2杂化,平面正六边形,故D错误;
故选D.
| 1 |
| 2 |
B.SiH4中价层电子对个数=4+
| 1 |
| 2 |
C.BCl3中价层电子对个数=3+
| 1 |
| 2 |
D.C6H6中的C含有3个σ 键且不含孤电子对,所以碳原子采用sp2杂化,平面正六边形,故D错误;
故选D.

练习册系列答案
相关题目
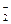 和H2F
和H2F