题目内容
【题目】I.下图所示装置,装置A是氢氧燃料电池,已知该装置工作时电子从b极流向Fe电极。
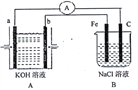
(1)C电极反应式为___________________________。
(2)若装置B中溶液体积为100mL,假设反应前后溶液体积不变,当装置A中消耗0.05mol氢气时,装置B中溶液的pH为_____,此时要恢复原溶液的浓度需加入______(填化学式)。
(3)若将装置B改为电解精炼铜,则粗铜作____极,阴极反应为_________。
II.用零价铁(Fe)去除水体中的的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中(NO3-)的反应原理如图所示。
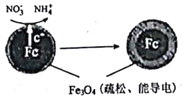
①作负极的物质是_______________。②正极的电极反应式是_________________________。
(2)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在___极,该电极反应式是_______________________________________________。
【答案】 2Cl--2e-=Cl2↑ 14 HCl 阳 Cu2++2e- =Cu Fe NO3-+8e-+10H+=NH4++3H2O 阴极 CO2+6H++6e-=CH3OH+H2O
【解析】本题主要考查原电池原理及电解池原理。
I.(1) 该装置工作时电子从b极流向Fe电极,Fe电极作阴极,相应地C电极作阳极,反应式为2Cl--2e-=Cl2↑。
(2)A、B两装置的电子守恒,当装置A中消耗0.05mol氢气时,装置B溶液中生成0.1molOH-,c(OH-)=1mol/L,溶液的pH为14,装置B中产生氢气和氯气,此时要恢复原溶液的浓度需加入HCl。
(3)若将装置B改为电解精炼铜,则粗铜作阳极,阴极反应为Cu2++2e- =Cu。
II.(1)①Fe被氧化,作负极的物质是Fe。②由图可知在正极上NO3-被还原为NH4+,正极电极反应式是NO3-+8e-+10H+=NH4++3H2O。
(2)甲醇是还原产物,则生成甲醇的反应发生在阴极,该电极反应式是CO2+6H++6e-=CH3OH+H2O。

 阅读快车系列答案
阅读快车系列答案【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下:
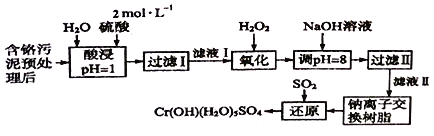
已知:
①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)酸浸时,为了提高浸取率可采取的措施有_________________(写出两条)。
(2)过滤操作时所用玻璃仪器除烧杯外,还需要________________。
(3)H2O2的作用是将滤液I中的Cr3+转化为C2O72-,该反应的离子方程式为:____________________。
(4)加入NaOH溶液调节溶液pH=8,既可以使溶液中某些杂质离子转化为沉淀,同时又可以将Cr2O72-转化为________(填微粒的化学式),当溶液的pH>8时,沉淀的主要成份为________ (填化学式)。
(5)钠离子交换树脂的反应原理为:Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有________________,交换后溶液中浓度明显增大的离子为________________。


