题目内容
下列各表示式中轨道数最多的是( )
| A、7s | B、6p | C、5d | D、4f |
分析:S原子轨道呈球形,只有一个空间伸展方向,所以轨道数目为1,P原子轨道呈纺锤形,有三个空间伸展方向所以轨道数目为3,d原子轨道有五个空间伸展方向所以轨道数目为5,f原子轨道有七个空间伸展方向所以轨道数目为7.
解答:解:S原子轨道呈球形,只有一个空间伸展方向,所以轨道数目为1,P原子轨道呈纺锤形,有三个空间伸展方向所以轨道数目为3,d原子轨道有五个空间伸展方向所以轨道数目为5,f原子轨道有七个空间伸展方向所以轨道数目为7,故选D.
点评:本题考查原子核外电子的能级分布中原子轨道,属于基础题,记忆的基础上理解.

练习册系列答案
相关题目
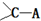 所得ABCD的结构式为
所得ABCD的结构式为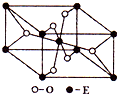 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.