题目内容
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的基态原子的外围电子排布式为
(2)下列叙述正确的是
a.M与水分子间能形成氢键,N是非极性分子
b.M和二氧化碳分子中的中心原子均采用sp2杂化
c.N分子中含有6个σ键和1个π键
d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
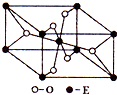
(3)E的一种氧化物Q,其晶胞结构如右上图所示,则Q的化学式为
(4)电镀厂排放的废水中常含有剧毒的BC-离子,可在Q的催化下,先用NaClO将BC-氧化成BCD-,再在酸性条件下BCD-继续被NaClO氧化成C2和BD2.
①A、B、C、D四种元素的电负性由小到大的顺序为
②与BCD-互为等电子体的分子、离子的化学式依次为
③上述反应中后一步反应的离子方程式是
(5)在浓的ECl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为ECl3?6H20的绿色晶体,该晶体中两舞更体的物质的量之比为1:5,则该配离子的化学式为
分析:A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同,短周期s区,只有ⅠA有单电子,则A为氢元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,则B原子电子排布式为1s22s22p2,故B为碳元素;D原子的核外成对电子数是未成对电子数的3倍,短周期元素未成对电子数可能为1、2、3,若为1,D为Li元素,原子序数小于碳元素,不符合,若为2,核电子总数为8,符合题意,D为氧元素,若为3,核电子总数为12,没有单电子,不符合题意,故D为氧元素;C元素介于碳元素与氧元素之间,故C为氮元素;E4+离子和氩原子的核外电子排布相同,则E的质子数为18+4=22,则E为Ti元素.
A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,则M为HCHO;A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂,则N为B苯,据此解答.
A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,则M为HCHO;A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂,则N为B苯,据此解答.
解答:解:A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同,短周期s区,只有ⅠA有单电子,则A为氢元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,则B原子电子排布式为1s22s22p2,故B为碳元素;D原子的核外成对电子数是未成对电子数的3倍,短周期元素未成对电子数可能为1、2、3,若为1,D为Li元素,原子序数小于碳元素,不符合,若为2,核电子总数为8,符合题意,D为氧元素,若为3,核电子总数为12,没有单电子,不符合题意,故D为氧元素;C元素介于碳元素与氧元素之间,故C为氮元素;E4+离子和氩原子的核外电子排布相同,则E的质子数为18+4=22,则E为Ti元素.
A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,则M为HCHO;A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂,则N为B苯,
(1)E为Ti元素,核外电子数为22,其基态原子的外围电子排布式为3d24s2,故答案为:3d24s2;
(2)a.HCHO中氧原子与水中的H原子之间可以形成氢键,苯是平面正六边形对称结构,为非极性分子,故a正确;
b.HCHO分子中碳原子成2个C-H键、1个C=O键,杂化轨道数为3,碳原子采取sp2杂化,二氧化碳分子中碳原子成2个C=O键,碳原子杂化轨道数为2,碳原子采用sp杂化,故b错误;
c.苯分子中含有12个σ键和1个大π键,故c错误;
d.CO2晶体属于分子晶体,二氧化硅属于原子晶体,CO2晶体的熔点、沸点都比二氧化硅晶体的低,故d正确;
故答案为:ad;
(3)由晶胞结构可知,晶胞中Ti元素数目为1+8×
=2,O原子数目为2+4×
=4,故该氧化物的化学式为TiO2,由晶胞结构可知,每个O原子周围有3个Ti原子,氧的配位数为3,故答案为:TiO2;3;
(4)①非金属性越强,电负性越强,同周期自左而右增大,故电负性H<C<N<O,故答案为:H<C<N<O;
②CNO-的等电子体的分子、离子的化学式依次为CO2、SCN-等,故答案为:CO2、SCN-等
③CNO-被NaClO氧化成N2和CO2,同时还有为C1-,反应离子方程式为:2CNO-+2H++3ClO-=N2↑+2CO2↑+3C1-+H2O,
故答案为:2CNO-+2H++3ClO-=N2↑+2CO2↑+3C1-+H2O;
(5)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3?6H20的绿色晶体,该晶体中两配体的物质的量之比为1:5,则配体中有1个Cl-、5个H2O,2个氯离子位于外界,则该配离子的化学式为[TiCl(H2O)5]2+,故答案为:[TiCl(H2O)5]2+.
A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,则M为HCHO;A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂,则N为B苯,
(1)E为Ti元素,核外电子数为22,其基态原子的外围电子排布式为3d24s2,故答案为:3d24s2;
(2)a.HCHO中氧原子与水中的H原子之间可以形成氢键,苯是平面正六边形对称结构,为非极性分子,故a正确;
b.HCHO分子中碳原子成2个C-H键、1个C=O键,杂化轨道数为3,碳原子采取sp2杂化,二氧化碳分子中碳原子成2个C=O键,碳原子杂化轨道数为2,碳原子采用sp杂化,故b错误;
c.苯分子中含有12个σ键和1个大π键,故c错误;
d.CO2晶体属于分子晶体,二氧化硅属于原子晶体,CO2晶体的熔点、沸点都比二氧化硅晶体的低,故d正确;
故答案为:ad;
(3)由晶胞结构可知,晶胞中Ti元素数目为1+8×
| 1 |
| 8 |
| 1 |
| 2 |
(4)①非金属性越强,电负性越强,同周期自左而右增大,故电负性H<C<N<O,故答案为:H<C<N<O;
②CNO-的等电子体的分子、离子的化学式依次为CO2、SCN-等,故答案为:CO2、SCN-等
③CNO-被NaClO氧化成N2和CO2,同时还有为C1-,反应离子方程式为:2CNO-+2H++3ClO-=N2↑+2CO2↑+3C1-+H2O,
故答案为:2CNO-+2H++3ClO-=N2↑+2CO2↑+3C1-+H2O;
(5)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3?6H20的绿色晶体,该晶体中两配体的物质的量之比为1:5,则配体中有1个Cl-、5个H2O,2个氯离子位于外界,则该配离子的化学式为[TiCl(H2O)5]2+,故答案为:[TiCl(H2O)5]2+.
点评:本题综合性较大,涉及结构性质位置关系、元素周期律、核外电子排布、配合物与杂化理论、分子结构,氧化还原反应等,难度中等,是物质结构的综合性题目,是对学生综合能力的考查,推断元素是解题的关键.

练习册系列答案
相关题目
已知A、B、C、D分别是Cu、Ag、Fe、Al四种金属中的一种.已知①A、C均能与稀硫酸反应放出气体;②B与D的硝酸盐反应,置换出单质D;③C与强碱反应放出气体,由此可以推断A、B、C、D依次是( )
| A、Fe、Cu、Al、Ag | B、Al、Cu、Fe、Ag | C、Cu、Ag、Al、Fe | D、Ag、Al、Cu、Fe |

 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素. (Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
(Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答: