��Ŀ����
����Ŀ����һ���¶��£��ı䷴Ӧ����n(SO2���Է�Ӧ2SO2��g��+O2��g��![]() 2SO3��g����H<0��Ӱ����ͼ��ʾ������˵����ȷ����
2SO3��g����H<0��Ӱ����ͼ��ʾ������˵����ȷ����
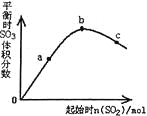
A. ��Ӧb��c���Ϊƽ��㣬a��δ��ƽ����������Ӧ�������
B. a��b��c�����ƽ�ⳣ��Kb>Kc>Ka
C. ����ͼ����Եó�SO2�ĺ���Խ�ߵõ��Ļ��������SO3���������Խ��
D. a��b��c�����У�a��ʱSO2��ת�������
���𰸡�D
�����������������A����������ƽ��ʱSO3���������������a��b��c���Ϊƽ��㣬A����B���¶Ȳ��䣬ƽ�ⳣ�����䣬B����C������ͼ����Եó�����SO2�ĺ��������࣬���������SO3����������������ֽ��ͣ�C����D������SO2�������࣬SO2��ת���ʽ��ͣ���a��ʱSO2��ת������ߣ�D��ȷ����ѡD��

 ͨ��ѧ��Ĭд����ϵ�д�
ͨ��ѧ��Ĭд����ϵ�д� ���ƽ̸�������ѡ����ĩ���100��ϵ�д�
���ƽ̸�������ѡ����ĩ���100��ϵ�д�����Ŀ��a mol O2�����a mol O3������Ƚϣ���������һ����ȷ����
A. �����ͬ B. ԭ������� C. ��������� D. �������
����Ŀ����1.0L�ܱ������з���0.10mol A��g������һ���¶Ƚ������·�Ӧ��A��g���TB��g��+C��g����H=+85.1kJmol��1��Ӧʱ�䣨t����������������ѹǿ��p�������ݼ�����
ʱ��t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
��ѹǿp/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
�ش��������⣺
��1�������A��ƽ��ת���ʣ�Ӧ��ȡ�Ĵ�ʩΪ��д�������ʩ����
��2������ѹǿp����ʼѹǿp0���㷴Ӧ��A��ת���ʦ���A���ı���ʽΪ �� ƽ��ʱA��ת����Ϊ �� ��ʽ�����㷴Ӧ��ƽ�ⳣ��K ��
��3������ѹǿp����ʼѹǿp0��ʾ��Ӧ��ϵ�������ʵ���n���ͷ�Ӧ��A�����ʵ���n��A����n���ܣ�=mol��n��A��=mol��

