题目内容
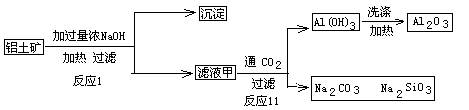
硫酸钡是惟一无毒的钡盐,工业上以BaSO4等为原料通入图所示流程反应可以制备锌钡白和过氧化氢:
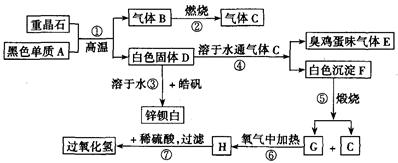
(1)上述流程中共有7个化学反应,其中有__________个属于氧化还原反应。
(2)写出过氧化氢的电子式:__________;写出物质H的电子式:__________。
(3)写出下列化学反应方程式:
反应①:____________________;
反应③:____________________;
反应④:____________________;
反应⑦:____________________。

(1)上述流程中共有7个化学反应,其中有__________个属于氧化还原反应。
(2)写出过氧化氢的电子式:__________;写出物质H的电子式:__________。
(3)写出下列化学反应方程式:
反应①:____________________;
反应③:____________________;
反应④:____________________;
反应⑦:____________________。
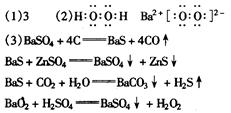
重晶石是BaSO4,黑色单质A通常是碳。由BaSO4和单质碳高温生成气体B,B燃烧生成气体C,可知B是CO,C是CO2。有臭鸡蛋气味的气体E是H2S,而H2S是由D溶于H2O通入CO2所得,则D中含S2-。BaSO4和单质碳高温生成气体CO,同时生成白色固体D,则D是BaS。BaS溶于H2O,与皓矾(ZnSO4·7H2O)反应生成锌钡白(BaSO4和BaS的混合物)。BaS溶于H2O 通入CO2产生H2S,同时生成白色沉淀F,可知F是BaCO3。进一步推出G是BaO,H是BaO2,BaO2与稀H2SO4反应生成BaSO4沉淀和H2O2。

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目



 族
族
