题目内容
常温时,将某一元酸HA溶液与NaOH溶液等体积混合:
(1)若c (HA) = c (NaOH) =0.lmol/L,测得混合后溶液的pH>7。
①不能证明HA是弱电解质的方法是( )
A.测得0. 1mol/L HA的pH>l
B.测得NaA溶液的pH>7
C.pH=l的HA溶液与盐酸,稀释100倍后,盐酸的pH变化大
D.用足量锌分别与相同pH、相同体积的盐酸和HA溶液反应,产生的氢气一样多
②混合溶液中,关系式一定正确的是 ( )
A.c(A-)>c(Na+)>c(OH-)>c(H+)
B.c(A-)+c(OH-)=c(Na+)+c(H+)
C.c(HA)+c(A-)=0.1mol/L
D.c( HA) +c( H+)=c(OH-)
③若HA+B2-(少量)=A-+HB-、H2B(少量)+2C-=B2-+2HC、HA+C-=A-+HC,则相同pH的①NaA溶液;②Na2B溶液;③NaHB溶液;④NaC溶液,其物质的量浓度由大到小的顺序为 (填序号)。
(2)若c( HA)=c(NaOH)=0.1mol/L,测得混合后溶液的pH=7。
①现将一定浓度的HA溶液和0.1 mol/L NaOH溶液等体积混合后,所得溶液的pH跟该浓度的HA溶液稀释10倍后所得溶液的pH相等,则HA溶液的物质的量浓度为 mol/L。
②用标准的NaOH溶液滴定未知浓度的HA时,下列操作能引起所测HA浓度偏大的是 。
A.用蒸馏水洗涤锥形瓶后,用待测HA溶液进行润洗
B.滴定前发现滴定管的尖嘴部分有气泡,滴定后消失
C.装NaOH的碱式滴定管未用标准的NaOH溶液润洗
D.滴定前仰视,滴定后俯视读数
(3)若c(HA)= 0.04 mol/L,c(NaOH)=0.02 mol/L。
①若HA为CH3COOH,二者等体积混合后该溶液显酸性,则溶液中所有离子按浓度由大到小排列的顺序是 。
②若HA为强酸,99℃时(Kw=10-12),将两种溶液等体积混合后,溶液中由水电离出的H+浓度为 _ _ mol/L(假设混合后溶液体积为两溶液体积之和)。
(1)D ② BD ③ ③①②④ (2)0.125mol/L ② ABC
(3)c(A-)>c(Na+)>c(H+)>c(OH-) (或c(CH3COO-)>c(Na+)>c(H+)>c(OH-));10-10
解析试题分析:(1)①弱电解质的证明,是基于与强电解质对比进行的。弱电解质与强电解质最大的区别就 是弱电解质存在电离平衡,而强电解质不存在电离平衡。因此只要证明有电离平衡存在, 就证明了弱电解质。A、如果HA是强酸,则0.1mol/L的HA溶液的pH=1,所以如果测得0.1mol/L HA的pH>l,这说明HA没有完全电离,存在电离平衡,即HA是弱电解质,A不符合题意;B、如果测得NaA溶液的pH>7,这说明-在溶液中水解,溶液显碱性,因此相应的是弱电解质,B不符合题意;C、盐酸是强酸,完全电离。因此如果pH=l的HA溶液与盐酸,稀释100倍后,盐酸的pH变化大,这就说明HA溶液中存在电离平衡,属于弱电解质,C不符合题意;D、如果用足量锌分别与相同pH、相同体积的盐酸和HA溶液反应,产生的氢气一样多,则说明两种酸的浓度是相同的。由于盐酸是强酸,因此HA也一定是强电解质,D符合题意,答案选D。
②c (HA)=c (NaOH)=0.lmol/L,则二者等体积混合恰好反应时生成NaA。测得混合后溶液的pH>7,这说明A-水解,溶液显碱性。则A、c(Na+)>c(A-)>c(OH-)>c(H+),A不正确;B、根据电荷守恒可知c(A-)+c(OH-)=c(Na+)+c(H+),B正确;C、根据物料守恒可知c(HA)+c(A-)=c(Na+)=0.1mol/L÷2=0.05mol/L,C不正确;D、根据质子守恒可知c( HA) +c( H+)=c(OH-),D正确,答案选BD。
③若HA+B2-(少量)=A-+HB-、H2B(少量)+2C-=B2-+2HC、HA+C-=A-+HC,则根据较强酸制备较弱酸可知,酸性强弱顺序是H2B>HA>HB->HC。由于酸性越强,相应的钠盐越容易水解,溶液的碱性越强,pH越大,因此在相同条件下水解程度的大小顺序是C->B2->A->HB-。所以相同pH的 ①NaA溶液 ②Na2B溶液 ③NaHB溶液 ④NaC溶液,其物质的量浓度由大到小的顺序为③①②④。
(2)若c( HA)=c(NaOH)=0.1mol/L,则二者等体积混合恰好反应时生成NaA。测得混合后溶液的pH=7,这说明生成物不水解,因此HA是强酸。
①现将一定浓度的HA溶液和0.1 mol/L NaOH溶液等体积混合后,所得溶液的pH跟该浓度的HA溶液稀释10倍后所得溶液的pH相等,则如果设HA溶液的物质的量浓度为cmol/L,则 =0.1cmol/L,解得c=0.125,即HA溶液的浓度是0.125mol/L。
=0.1cmol/L,解得c=0.125,即HA溶液的浓度是0.125mol/L。
②由 可知,由于C标、V测均为定植,所以C测的大小取决于V标的大小,即V标:偏大或偏小,则C测偏大或偏小,据此可以判断。A、用蒸馏水洗涤锥形瓶后,用待测HA溶液进行润洗,则消耗氢氧化钠溶液的体积增加,所以测量值偏高;B、滴定前发现滴定管的尖嘴部分有气泡,滴定后消失,则消耗氢氧化钠溶液的体积增加,所以测量值偏高;C、装NaOH的碱式滴定管未用标准的NaOH溶液润洗,则氢氧化钠溶液的浓度被稀释,消耗氢氧化钠溶液的体积增加,所以测量值偏高;D、滴定前仰视,读数偏大。滴定后俯视读数,读数偏小,因此消耗氢氧化钠溶液的以及减少,测量值偏低,答案选ABC。
可知,由于C标、V测均为定植,所以C测的大小取决于V标的大小,即V标:偏大或偏小,则C测偏大或偏小,据此可以判断。A、用蒸馏水洗涤锥形瓶后,用待测HA溶液进行润洗,则消耗氢氧化钠溶液的体积增加,所以测量值偏高;B、滴定前发现滴定管的尖嘴部分有气泡,滴定后消失,则消耗氢氧化钠溶液的体积增加,所以测量值偏高;C、装NaOH的碱式滴定管未用标准的NaOH溶液润洗,则氢氧化钠溶液的浓度被稀释,消耗氢氧化钠溶液的体积增加,所以测量值偏高;D、滴定前仰视,读数偏大。滴定后俯视读数,读数偏小,因此消耗氢氧化钠溶液的以及减少,测量值偏低,答案选ABC。
(3)①若HA为CH3COOH,二者等体积混合后醋酸过量,即溶液是由相同浓度的醋酸、醋酸钠构成的。该溶液显酸性,这说明醋酸的电离程度大于CH3COO-的水解程度,则溶液中所有离子按浓度由大到小排列的顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。
②HA为强酸,二者等体积混合后HA过量,即溶液是由相同浓度的HA、NaA构成的,且浓度都是0.02mol/L÷2=0.01mol/L。因此溶液中OH-浓度=10-12÷0.01=10-10mol/L。HA是强酸,抑制水的电离,则溶液中由水电离出的H+浓度=溶液中OH-浓度=10-10mol/L。
考点:考查弱电解质的电离、盐类水解、弱电解质的判断、溶液中离子浓度大小比较、中和滴定实验误差分析以及水的离子积常数和pH的计算

七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
表2 两种盐的溶解度(单位为g/100g水)
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |
硼镁泥制取七水硫酸镁的工艺流程如下:
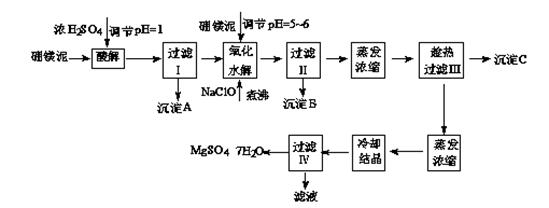
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 。加热煮沸的主要目的是 。
(2)沉淀B中除MnO2、SiO2外还含有 (填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 ;
(4)沉淀C的化学式是 。过滤III需趁热过滤的理由是
25℃时,电离平衡常数:
| 化学式 | CH3COOH | H2CO3 | HClO | H2C4H4O6(酒石酸) | H2SO3 |
| 电离平衡常数 | 2.0×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=9.1×10-4 K2=4.3×10-5 | K1=1.3×10-2 K2=6.3×10-8 |
回答下列问题:
(1)pH相同的下列物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa d.NaHCO3 e.Na2C4H4O6;物质的量浓度由大到小的顺序是 (填字母)。
(2)常温下,0.1mol/L的CH3COOH溶液的pH= (已知lg2=0.3)。
(3)常温下,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,所得溶液中各种离子浓度关系正确的是
A.c(Na+) > c(ClO-) >c(HCO3-) >c(OH-)
B.c(Na+) > c(HCO3-) >c(ClO-) > c(H+)
C.c(Na+) = c(HClO) +c(ClO-)+ c(HCO3-) + c(H2CO3)+ c(CO32-)
D.c(Na+) + c(H+)= c(ClO-)+ c(HCO3-) + 2c(CO32-)
E.c(HClO) + c(H+)+ c(H2CO3)= c(OH-) + c(CO32-)
(4)写出少量的CO2通入NaClO溶液中的化学方程式 。
(5)0.1mol/L的酒石酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC4H4O6-)+2 c(C4H4O62-)= 。(用准确的数值表示)
工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下: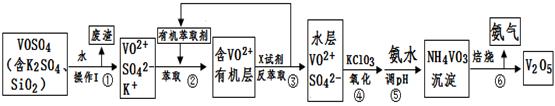
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。③中X试剂为 。
(3)⑤的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。
【已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39】
(5)该工艺流程中,可以循环利用的物质有 和 。
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。
从废料中回收氧化钴(CoO)的工艺流程如下: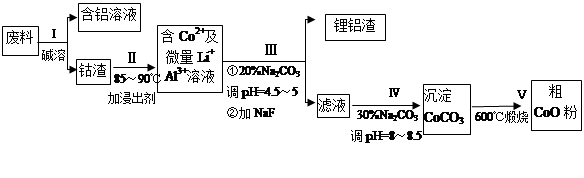
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式________ ____________。
(3)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是 。
(4)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是___ ___(填序号)。
| A.c(Na+) = 2c(CO32-) |
| B.c(Na+) > c(HCO3-) > c(CO32-) |
| C.c(OH-) > c(HCO3-) > c(H+) |
| D.c(OH-) - c(H+) = c(HCO3-) + 2c(H2CO3) |
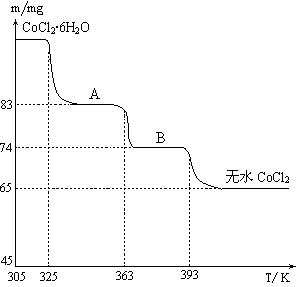
结合下表回答下列问题:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 溶度积/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
(2)在空气中直接加热CuCl2?2H2O晶体得不到纯的无水CuCl2,由CuCl2?2H2O晶体得到纯的无水CuCl2的合理方法是___________________________________________。
 H++A2-。
H++A2-。
