题目内容
某二元酸(化学式用H2A表示)在水溶液中的电离方程式是:
H2A=H++HA-,HA- H++A2-。
H++A2-。
试回答下列问题:
(1)Na2A溶液显________(填“酸性”、“中性”或“碱性”),理由是_____________________(用离子方程式表示)。
(2)若0.1 mol·L-1 NaHA溶液的pH=2,则0.1 mol·L-1 H2A溶液中H+的物质的量浓度________0.11 mol·L-1。(填“>”、“=”或“<”)
(3)0.1 mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是___________________。
(1)碱性 A2-+H2O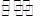 HA-+OH-;(2)<(3)c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
HA-+OH-;(2)<(3)c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
解析试题分析:(1)Na2A是强碱弱酸可盐,水解显碱性,方程式如下: A2-+H2O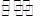 HA-+OH-;
HA-+OH-;
(2)0.1 mol·L-1 NaHA溶液的pH=2,表明由HA-所电离出的氢离子的浓度为0.01mol/L,则0.1 mol·L-1 H2A溶液中H+的物质的量浓度为:
H2A = H+ + HA-,
起始:0.1 mol·L-1 0 0
电离后:0 0.1 mol·L-1 0.1 mol·L-1
HA-  H+ + A2-
H+ + A2-
0.1 mol·L-1 0 0
若按照NaHA溶液中的电离情况,溶液中的氢离子浓度为:0.01 mol·L-1,但是受第一步电离的影响,第一步生成的氢离子对第二步产生了抑制作用,因此第二步的电离比在NaHA溶液中的电离情况要弱一点,所以有0.1 mol·L-1 H2A溶液中H+的物质的量浓度<0.11 mol·L-1。
(3)c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)。
考点:考查强弱电解质的电离。

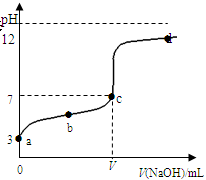
在常温下向20mL 0.1 mol·L-1某酸(用HAc表示)溶液中逐滴加入0.1 mol·L-1 NaOH溶液,用pH计来测定溶液中pH数据如下表,作出pH与NaOH溶液体积关系的曲线如图所示(忽略温度变化)。请根据表中数据和滴定曲线回答以下问题:
| V(NaOH)mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| pH | 3.0 | 4.7 | 5.7 | 6.7 | 7.7 | 8.7 | 9.7 | 10.7 | 11.7 | 12.5 |
(2)当V (NaOH)=20.00mL时,请写出溶液中主要存在的两种平衡状态的表示式_______________、________________;溶液中离子浓度由大到小的顺序是___________________;
(3)a、b、c、d四点对应溶液中水的电离程度由大到小的顺序是_________________。
(4)该温度下,滴定曲线上c点时HAc的电离平衡常数Ka=_______(用含V的代数简式表示)。