题目内容
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:
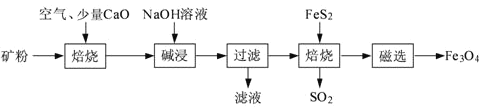
(1)粉碎高硫铝土矿石的目的是______。
(2)焙烧时发生氧化还原反应:______FeS2+______O2![]() ______Fe2O3+______SO2↑,配平该方程式。
______Fe2O3+______SO2↑,配平该方程式。
(3)碱浸时发生反应的化学方程式为______。
(4)过滤后向滤液中通入过量的CO2气体,反应的离子方程式为______。
(5)“过滤”得到的滤渣中含有大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2):n(Fe2O3)=______。
【答案】增大接触面积,加快反应速率 4 11 2 8 Al2O3+2NaOH=2NaAlO2+H2O OH-+CO2=HCO3-、AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓ 1:16
【解析】
高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)粉碎后通入空气、加入氧化钙焙烧,其中氧化钙和二氧化硫反应生成亚硫酸钙,和二氧化硅反应生成硅酸钙,得到产物加入氢氧化钠溶液碱浸,其中氧化铝溶解生成偏铝酸钠溶液,经操作I得到的固体中含Fe2O3,Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,以此解答该题。
(1)粉碎高硫铝土矿的目的是增加接触面积,加快反应速率,提高浸出率;答案为增加接触面积,加快反应速率;
(2)反应中Fe元素化合价从+2价升高到+3价,S元素化合价从-1价升高到+4价,氧元素化合价从0价降低到-2价,根据电子得失和原子守恒可知配平后的反应方程式为4FeS2+11O2![]() 2Fe2O3+8SO2;
2Fe2O3+8SO2;
(3)Al2O3为两性氧化物,SiO2为酸性氧化物,Fe2O3为碱性氧化物,焙烧时,除发生FeS2的反应,还发生CaO与SiO2的反应,生成CaSiO3,即碱浸时发生的反应方程式为Al2O3+2NaOH=2NaAlO2+H2O;
(4)过滤后,滤液中有NaAlO2和NaOH,通入过量的CO2发生的离子方程式为AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓、OH-+CO2=HCO3-;
(5)Fe2O3与FeS2发生的反应方程式为FeS2+16Fe2O3![]() 11Fe3O4+2SO2↑,理论上完全反应消耗的n(FeS2):n(Fe2O3)=1:16。
11Fe3O4+2SO2↑,理论上完全反应消耗的n(FeS2):n(Fe2O3)=1:16。

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案