题目内容
【题目】2mol CO2中含有________mol O原子,含有____________个CO2分子,质量为_________g ;
CO2的摩尔质量是_______________,在标准状况下的密度是______________,同温同压条件下该气体与氢气的密度之比是______________。
【答案】4 1.204×1024 88 44 g/mol 1.96g/L 22:1
【解析】
1个CO2分子中含有2个O原子,所以2mol CO2中含有4mol O原子,根据![]() ,2mol CO2中含有2×6.02×1023=1.204×1024个CO2分子,根据
,2mol CO2中含有2×6.02×1023=1.204×1024个CO2分子,根据![]() ,2mol CO2的质量为2mol×44g/mol= 88g;
,2mol CO2的质量为2mol×44g/mol= 88g;
摩尔质量用g/mol作单位时,摩尔质量的数值等于相对分子质量,所以CO2的摩尔质量是44 g/mol,1mol CO2的质量是1mol×44 g/mol= 44g, 1mol CO2在标准状况下的体积是1mol×22.4 L/mol =22.4L,在标准状况下的密度是![]() 1.96g/L,根据阿伏加德罗定律的推论,同温同压条件下,气体密度之比等于气体摩尔质量之比,所以该气体与氢气的密度之比是44:2=22:1。
1.96g/L,根据阿伏加德罗定律的推论,同温同压条件下,气体密度之比等于气体摩尔质量之比,所以该气体与氢气的密度之比是44:2=22:1。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
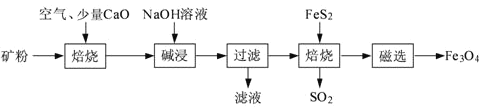
全优测试卷系列答案【题目】如图是铁与水蒸气反应的实验装置。在硬质玻璃管中放入还原铁粉和石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。
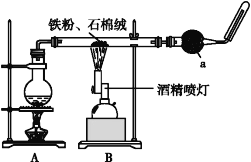
(1)该实验反应的反应方程式为:___。
(2)仪器a的名称是___。
(3)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成气体的体积,计算铁粉的转化率。
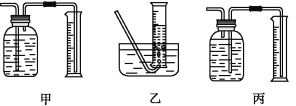
①该同学应该先点燃__(填“A”或“B”)处的酒精灯(或酒精喷灯),测量气体体积不可以选用上图中___(填“甲”“乙”或“丙”)装置。
②称取5.6g铁粉与适量石棉绒混合,然后加热反应一段时间。若测出的气体体积在标准状况下为0.896L,则铁粉的转化率为__。(转化率=![]() )
)
(4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,为探究反应后溶液中可能的阳离子,小林同学进行如下实验,请你将下表补充完整:
步骤 | 现象 | 解释(用离子方程式表示) | 结论 |
Ⅰ.取样,滴加KSCN溶液 | 溶液不变红色(Fe3+与KSCN溶液反应显红色) | ①Fe3O4+8H+=Fe2++2Fe3++4H2O ②____ | Ⅲ.反应后的溶液中阳离子为___ |
Ⅱ.取样,滴加NaOH溶液 | 刚开始无明显现象,一段时间后先出现白色沉淀,迅速变为灰绿色,最终变为红褐色 | ①___ ②Fe2++2OH—=Fe(OH)2↓(白色) 4Fe(OH)2+2H2O+O2=4Fe(OH)3 |