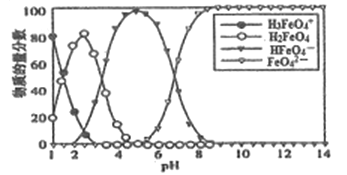
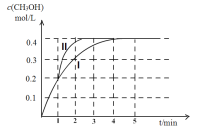
题目内容
【题目】反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如下图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如下图所示,回答下列问题。
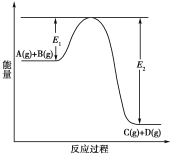
(1)该反应是________反应(填“吸热”或“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率________(填“增大”、“减小”或“不变”)
(3)反应体系中加入催化剂对反应热是否有影响?___________________________________(填“有”、或“无”)
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1________,E2________(填“增大”、“减小”或“不变”)。
【答案】放热减小无减小减小
【解析】
(1)由反应过程中的能量变化图可以知道,反应物的总能量高于生成物的总能量,故反应为放热反应,因此,本题正确答案是:放热;
(2)该反应正反应是放热反应,升高温度平衡向逆反应移动,A的转化率减小,因此,本题正确答案是:减小;
(3)加入催化剂改变了反应的途径,降低反应所需的活化能,但催化剂不改变反应物总能量与生成物总能量之差即反应热不变,所以对该反应的反应热无影响;
因此,本题正确答案是:无影响;催化剂不改变反应物总能量与生成物总能量之差;
(4)加入催化剂改变了反应的途径,降低反应所需的活化能,所以E1和E2的变化都减小,
因此,本题正确答案是:减小;减小;催化剂改变了反应的途径,降低了反应所需的活化能;

练习册系列答案
相关题目