题目内容
9.下列方法可以证明2HI(g)?H2(g)+I2(g)已达平衡状态的是②③⑤①单位时间内生成nmolH2的同时生成nmolHI;
②一个H-H 键断裂的同时有两个H-I键断裂;
③反应速率v(H2)=v(I2)=0.5v(HI)时;
④C(HI)=c(H2)=c(I2)=2:1:1且保持不变;
⑤温度和体积一定时,某一生成物浓度不再变化;
⑥温度和体积一定时,容器内压强不再变化;
⑦温度和压强一定时混合气体密度不再变化.
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①单位时间内生成n mol H2的同时,生成n mol HI,速率之比不等于物质的量之比,故错误;
②一个H-H键断裂等效于两个H-I键形成的同时有两个H-I键断裂,故正确;
③反应速率v(H2)=v(I2)=0.5v(HI),体现正与逆的关系,而速率之比与计量数也不成比例,故正确;
④c(HI):c(H2):c(I2)=2:1:1),相等并不是不变,故错误;
⑤温度和体积一定时,生成物浓度不再变化,说明正逆反应速率相等,达平衡状态,故正确;
⑥温度和体积一定时,容器内压强不再变化,容器压强始终不变,故错误;
⑦条件一定,混合气体的平均相对分子质量不再变化,平衡相对分子质量一直不变,故错误;
故答案为:②③⑤.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
1.下列措施不合理的是( )
| A. | 用CCl4萃取碘水中的碘 | |
| B. | 将饱和FeCl3溶液滴入沸水中制备Fe(OH)3胶体 | |
| C. | 将混有少量HCl的Cl2通入饱和食盐水溶液中除去HCl | |
| D. | 常温下铝箔放在浓HNO3中,生成H2 |
2.下列叙述中正确的是( )
| A. | 常温常压下含有NA个原子的氦气体积约为22.4L | |
| B. | 常温常压下,O2和O3的混合物16g中约含有6.02×1023个氧原子 | |
| C. | 在0℃,101KPa时,22.4L氢气中含有NA个氢原子 | |
| D. | 标准状况下,33.6LH2O含有1.5NA个H2O分子 |
4.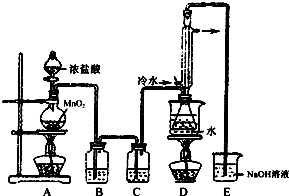 S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的反应原理有两种:
S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的反应原理有两种:
①CS2+3Cl2$\frac{\underline{\;95~100℃\;}}{\;}$CCl4+S2Cl2;
②2S+Cl2$\frac{\underline{\;111~140℃\;}}{\;}$S2Cl2.
已知:S2Cl2易与水反应,S2Cl2+Cl2$\stackrel{△}{?}$2SCl2.
下列是几种物质的熔沸点和反应装置图
(1)利用如图装置(部分夹持仪器已略去)来制备S2Cl2,反应原理是①(填写以上两种反应原理的数字序号).
(2)若装置C更换成干燥管,则装置C中可选用的固体试剂是无水氯化钙或五氧化二磷.
(3)D装置中冷凝管的作用是冷凝回流、导气;反应结束后,将D装置锥形瓶内的混合物中分离出产物的方法是蒸馏.
(4)S2Cl2与足量水反应有黄色沉淀生成,产生的无色气体能使品红溶液褪色,则该反应的化学方程式为2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑.
(5)为了提高制得的产品S2Cl2的纯度,关键的操作是控制好温度和控制浓盐酸的滴速不能太快.
(6)图中尾部装置不够完善,存在的问题是在D和E之间增加干燥装置,同时尾气吸收要防倒吸.
 S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的反应原理有两种:
S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的反应原理有两种:①CS2+3Cl2$\frac{\underline{\;95~100℃\;}}{\;}$CCl4+S2Cl2;
②2S+Cl2$\frac{\underline{\;111~140℃\;}}{\;}$S2Cl2.
已知:S2Cl2易与水反应,S2Cl2+Cl2$\stackrel{△}{?}$2SCl2.
下列是几种物质的熔沸点和反应装置图
| 物质 | 沸点/℃ | 熔点/℃ |
| S | 445 | 113 |
| CS2 | 47 | -109 |
| CCl4 | 77 | -23 |
| S2Cl2 | 137 | -77 |
(2)若装置C更换成干燥管,则装置C中可选用的固体试剂是无水氯化钙或五氧化二磷.
(3)D装置中冷凝管的作用是冷凝回流、导气;反应结束后,将D装置锥形瓶内的混合物中分离出产物的方法是蒸馏.
(4)S2Cl2与足量水反应有黄色沉淀生成,产生的无色气体能使品红溶液褪色,则该反应的化学方程式为2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑.
(5)为了提高制得的产品S2Cl2的纯度,关键的操作是控制好温度和控制浓盐酸的滴速不能太快.
(6)图中尾部装置不够完善,存在的问题是在D和E之间增加干燥装置,同时尾气吸收要防倒吸.
14.下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )
| A. | 将NaHCO3固体加入新制氯水,有无色气泡(HClO) | |
| B. | 使红色布条褪色(HClO) | |
| C. | 向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈血红色(Cl2) | |
| D. | 滴加AgNO3溶液生成白色沉淀(Cl-) |
1.120℃、101kPa时,由两种烃组成的混合气体0.5L在4.5L O2中完全燃烧,测得反应后气体总体积小于5L,其中含CO2 0.8L,则生成水蒸气的体积为( )
| A. | 0.7L | B. | 1.0L | C. | 1.6L | D. | 2.5L |
18.下列实验操作或处理事故的方法正确的是( )
| A. | 用干燥的pH试纸测定NaClO溶液的pH | |
| B. | 在耐高温的石英坩埚中进行熔化氢氧化钠固体的实验 | |
| C. | 用分液漏斗分离乙酸乙酯和水的混合物时,水从下口放出,乙酸乙酯从上口倒出 | |
| D. | 欲配制质量分数为10%的硫酸铜溶液,可准确称取10 g硫酸铜晶体溶于90 g水中 |