题目内容
11.乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸.为探究草酸的部分化学性质,进行了如下实验:(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为HCO3-+H2C2O4=HC2O4-+CO2↑+H2O.
(2)该小组同学将2.52g草酸晶体(H2C2O4?2H2O)加入到100mL 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性(忽略溶液体积变化),则下列关系合理的是CD.
A.c(Na+)+c(H+)=c(H2C2O4-)+c(OH-)+c(C2O42-)
B.c(H2C2O4-)+c(C2O42-)=0.2mol/L
C.c(H2C2O4-)>c(C2O42-)>c(H2C2O4)
D.c(Na+)=c(H2C2O4)+c(H2C2O4-)+c(C2O42-)
(3)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,有气泡产生,说明乙二酸具有还原性(填“还原性”、“氧化性”或“酸性”),请写出该反应的离子方程式:5H2C2O4+6H++2MO4-═2Mn2++10CO2↑+8H2O.
(4)乙二醇与乙二酸类似,每个碳上连一个羟基.现以乙烯为原料(其他无机试剂任选),写出由乙烯合成乙二醇的化学方程式.
分析 (1)草酸的酸性比碳酸强,故草酸与碳酸氢钠反应生成二氧化碳,由于草酸足量,故生成NaHC2O4;
(2)2.52g草酸晶体(H2C2O4•2H2O)的物质的量为$\frac{2.52g}{126g/mol}$=0.02mol,NaOH的物质的量为0.1L×0.2mol/L=0.02mol,二者正好1:1反应生成NaHC2O4,溶液显酸性,说明HC2O4-的电离程度大于其水解程度;A.根据电荷守恒判断;
B.根据物料守恒可知,溶液中草酸、醋酸根、草酸氢根的总浓度为0.2mol/L;
C.HC2O4-的电离程度大于其水解程度;
D.根据Na元素与C元素比例关系(物料守恒)判断;
(3)草酸被氧化为二氧化碳,把MnO4-还原为Mn2+,说明草酸具有还原性;
(4)乙烯与氯气发生加成反应生成ClCH2CH2Cl,再在氢氧化钠水溶液、加热条件下发生水解反应得到HOCH2CH2OH.
解答 解:(1)草酸的酸性比碳酸强,故草酸与碳酸氢钠反应生成二氧化碳,由于草酸足量,故还生成NaHC2O4,反应离子方程式为:HCO3-+H2C2O4=HC2O4-+CO2↑+H2O,
故答案为:HCO3-+H2C2O4=HC2O4-+CO2↑+H2O;
(2)2.52g草酸晶体(H2C2O4•2H2O)的物质的量为$\frac{2.52g}{126g/mol}$=0.02mol,NaOH的物质的量为0.1L×0.2mol/L=0.02mol,二者正好1:1反应生成NaHC2O4,溶液显酸性,说明HC2O4-的电离程度大于其水解程度.
A.根据电荷守恒:c(Na+)+c(H+)═c(HC2O4-)+c(OH-)+2c(C2O42-),故A错误;
B.反应后的溶液为0.2mol/L NaHC2O4溶液,由物料守恒可知,溶液中c(HC2O4-)+c(C2O42-)+c(H2C2O4)═0.2mol/L,故B错误;
C.HC2O4-的电离程度大于其水解程度,且电离程度不大,则溶液中c(HCO4-)>c( C2O42-)>c(H2C2O4),故C正确;
D.反应后的溶液为0.2mol/L NaHC2O4溶液,由钠元素与碳元素关系,可知溶液中c(Na+)═c(H2C2O4)+c( HC2O4-)+c(C2O42-),故D正确,
故选:CD;
(3)草酸被氧化为二氧化碳,把MnO4-还原为Mn2+,说明草酸具有还原性,反应离子方程式为:5H2C2O4+6H++2MO4-═2Mn2++10CO2↑+8H2O,
故答案为:还原性;5H2C2O4+6H++2MO4-═2Mn2++10CO2↑+8H2O;
(4)乙烯与氯气发生加成反应生成ClCH2CH2Cl,再在氢氧化钠水溶液、加热条件下发生水解反应得到HOCH2CH2OH,反应方程式为:CH2=CH2+Cl2→ClCH2CH2Cl、ClCH2CH2Cl+2NaOH$→_{△}^{水}$HOCH2CH2OH+2NaCl,
故答案为:CH2=CH2+Cl2→ClCH2CH2Cl、ClCH2CH2Cl+2NaOH$→_{△}^{水}$HOCH2CH2OH+2NaCl.
点评 本题比较综合,涉及离子方程式书写、微粒浓度比较、弱电解质的电离、氧化还原反应、有机物的合成等,属于拼合型题目,(1)为易错点,学生容易忽略草酸过量问题,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | GeO2不溶于NaOH溶液 | B. | 单质锗具有导电性 | ||
| C. | 锗易与盐酸反应放出H2 | D. | 锗是一种重要的半导体材料 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物中碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3.
(3)A与H形成共价化合物(填“离子”或“共价”),用电子式表示它的形成过程
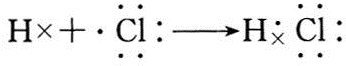 ;B与G形成离子化合物(填“离子”或“共价”),用电子式表示它的形成过程
;B与G形成离子化合物(填“离子”或“共价”),用电子式表示它的形成过程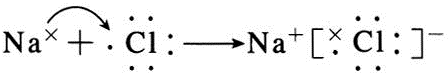 .
. | A | C | |
| B |
| A. | B为第二周期的元素 | B. | C为VA族元素 | ||
| C. | 三种元素都为非金属元素 | D. | B是化学性质最活泼的非金属 |

| A. | 钯电极N为正极 | |
| B. | 钯电极M上发生氧化反应 | |
| C. | SCY陶瓷固体电解质中H+移向钯电极N | |
| D. | 电池总反应方程式为N2+3H2═2NH3 |

