题目内容
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在 pH=5时沉淀完全).其中分析错误的是( )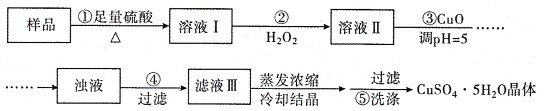
A. 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B. 步骤②不能用氯水、硝酸等强氧化剂代替H2O2
C. 步骤③用 CuCO3代替CuO也可调节溶液的pH
D. 滤液Ⅲ中无Fe3+,在后面的结晶过程中不会析出Fe2(SO4)3造成产品不纯,因此可直接用蒸发结晶的方法得到胆矾晶体。
【答案】D
【解析】
样品中CuO、FeO、Fe2O3与足量硫酸反应得到溶液I,溶液I中含CuSO4、FeSO4、Fe2(SO4)3和H2SO4;步骤②为H2O2将FeSO4氧化成Fe2(SO4)3;步骤③加入CuO调节pH除去Fe3+。A,步骤②中发生的主要反应为2Fe2++H2O2+2H+=2Fe3++2H2O,A项正确;B,步骤②中若用氯水、HNO3,一方面引入杂质离子,另一方面产生大气污染物,不能用氯水、HNO3代替H2O2,B项正确;C,CuCO3也能消耗H+从而调节pH,而且不引入新杂质,步骤③可用CuCO3代替CuO,C项正确;D,若用蒸发结晶胆矾会分解失去结晶水,不能直接用蒸发结晶得到胆矾晶体,D项错误;答案选D。

练习册系列答案
相关题目